投资美国医疗器械,你需要了解的背后故事(下篇) | 美柏研究
近年中国对美国医疗器械的投资与并购呈现非常明确的增长趋势。本文主要从美国医疗器械创新的各个角度,结合企业实际,来介绍这个全球医疗器械市场最大国的创业特点,帮助中国投资者从美国特定的市场、法规、社会等角度更好地理解美国创业公司和创业者,并在此基础上,对美国的医疗器械引入中国市场做一些讨论。
美国医疗器械创业公司的特点
在一个科研、应用和商业紧密相连的环境下,大家的任何一个好点子,都有机会变成一个创新产品、一个创业公司。
美国医疗器械的创业公司,跟很多其他创业公司一样,往往开始的时候只有几个人。他们有独特的想法,设计了一款医疗器械,并完成了专利的注册。如果是一款消费类产品,那么接下来,在拿到足够的资本后,就可以生产和销售了。
但是医疗器械不一样,因为在法规上,它受到美国FDA(U.S. Food and Drug Administration)的监管;在销售上,很多医院和诊所都组织或者加入了GPO(Group Purchasing Organization),通过整合器械的使用量,跟器械商谈判,来获得有利的采购价格。

不同于中国药监局(CFDA),我认为美国FDA的法规对创新公司更为有利。作为一个初创公司,几乎不可能有自己的工厂来生产产品。在消费领域,最常见的做法是创业公司把产品外包给第三方公司做代加工。
美国FDA也接受这个概念。只要产品设计公司(这个情况下即创业公司)和代加工公司均在FDA注册(备案),依照FDA的法规完成产品设计和生产即可。在这种情况下,创业公司负责医疗器械在FDA的法规注册,从而拥有产品在FDA的注册权,并可以随时更换代工厂商。
但在目前CFDA的法规下,这一操作是不合规的。CFDA要求医疗器械的注册商和制造商必须是同一家,而且目前实行的是审批制。
如果现在有一家医疗器械的初创公司,它有一个非常好的器械;这家初创公司必须通过跟中国当地的一家已经在CFDA注册的医疗器械制造商合作,由该制造商来向CFDA注册新产品,以后也由这家制造商来制造。
这是目前一个影响国内医疗器械创新的地方。如果创新器械需要在国内生产,一个常用的绕行方式就是把这个新器械作为进口医疗器械在CFDA注册,做一次出口和进口,就可以在国内销售。当然,同样的产品,如果能注册为国产医疗器械,可能就会多一些政策的红利。
除了设计和生产,医疗器械创业公司还少不了法规人员和销售人员。
经过多年的发展,美国出现一大批合同制的法规人员和销售人员(美国公司正式员工的雇用不存在合同,叫做at-will employment;只有临时工或者短期工才是合同制,不享有公司福利。这与中国的劳工机制不同)。
对于新器械的开发和注册(如果不是三类器械),法规人员的参与是有限的。这些负责法规的人,往往以合同工或者咨询(contractor/consultant)的方式,帮助创业公司完成新器械的FDA注册,并在需要时提供相应的法规咨询。
器械的销售人员也类似,他们跟附近的医院和诊所非常熟悉,为各个医疗器械公司提供销售服务,赚取佣金。这些人员我称之为基础设施,他们的普遍存在,很大程度上缩短了器械创新和上市的周期。
美国创新器械进入中国市场的讨论
前面我们说到,美国是目前全世界医疗器械消费
最大的市场,而中国,则是医疗器械市场发展
最快的国家。
2016年,中国医疗器械市场规模约为540亿美元,占全球15%,较2015年增长20.1%,其中72.7%的增长来自医院的采购。
随着人们生活水平逐步提高,城乡化差距的缩小,以及老龄化的加速,中国对医疗技术和产品的追求会不断提高。包括最近愈演愈烈的赴美就医,赴日就医,都是国内日益增长的医疗需求得不到满足的表现。
同时,我们知道全球第七大医疗公司康德乐在2017年11月正式出售了其在中国的全部医药业务,但仍然保留了在华医疗器械业务。可以看出国际公司对中国医疗器械行业发展的看好。
将美国创新医疗器械引入中国的时候,除了准确预估市场大小,还需要从以下几个方面考虑。
1. 支付方式
医疗器械很多时候不是由用户(患者)来直接支付的,涉及到保险公司、医院等等。即使用户的需求在,但如果中美的支付方式不一样,最后形成的市场大小也会有差异。
我们拿一个在美国非常普遍的器械,吸乳泵为例。
这个器械在很多美国的医疗保险中都是全额支付的。保险公司往往会跟多个品牌的吸乳泵制造商合作,为投保人推荐产品,同时降低保险公司的支付成本。这样一来,使用者不需要支付这个产品,却能享受产品带来的实惠,每个新妈妈一定会选择要一台这个设备。这个市场也就很快发展起来了。
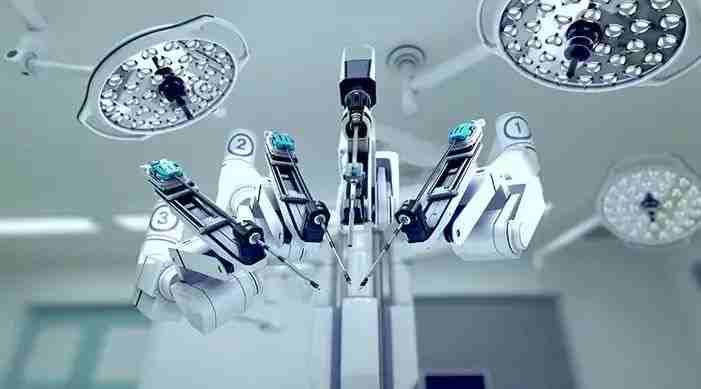
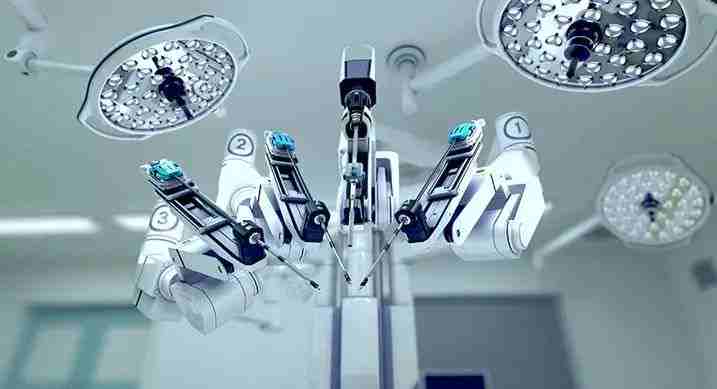
再举一个对比的例子,上海某医院已经引进了达芬奇手术机器人。
达芬奇手术机器人相比于传统的微创手术,能为医生提供更精确和便捷的操作。也就是说,同样的手术,医生可以借助一般的微创器械来完成,也可以借助达芬奇手术机器人来完成。
但是,目前中国的医保不为使用达芬奇手术机器人的手术进行支付。一台手术如果使用达芬奇机器人,一般费用在7~10万人民币,病人需要全部自费。相比于传统的由医保来支付的手术,选择的人就会少很多。
2016年底,复星医药投资4000万美元,与Intuitive Surgical公司,在原先代理达芬奇手术机器人的基础上深入合作,成立合资公司,发展手术机器人的国产化。希望在不久的将来老百姓都能用得起手术机器人。

达芬奇机器人
投资人在将美国器械引入中国的时候,需要对支付方式有一个充分的了解和比较。一个在美国卖得很好的器械,到中国可能就卖不动了。产业链上各个环节的差异会影响到一个器械的市场份额。
2. 法规评估
除了前面提到的,CFDA对国产器械注册商和制造商的捆绑要求之外,当国外最新技术进入中国市场时,需要考虑CFDA对新技术的接受程度。
从历史经验来看,CFDA无论从法规要求的制定还是对新器械的批准,都或多或少在效仿和跟随FDA的步伐。在对新技术和器械的批准上,很难超越FDA。即使FDA已经批准了的器械,如果技术上是超前的,CFDA也需要一段时间来理解和适应。这就会影响产品上市的时间。
另外,CFDA跟FDA还有欧盟医疗器械法规MDR(Europe Medical Devices Regulation)对同一个产品,可能存在不同的类别定义和法规要求。这就会导致各个机构对产品的开发、设计和生产,会有不同的要求。产品在一个法规体系下获得认证,不可简单的认为在其他法规体系下也可以照本宣科得来完成申请。投资者需要对这个法规审批时间有一个充分的了解,避免因为法规上的审批,延误产品上市。
3. 市场接受
前面提到,美国由于其缜密的法规要求和巨额的惩罚性赔偿,造就了一些市场特有的医疗器械。这些器械,
在其他市场并不一定适用。
一个很好的例子是,美国普遍使用的一次性器械的概念。从各式各样的一次性无菌器械,到各大医院手术室使用的个性化手术包概念,杜绝了器械由于重复灭菌使用带来的感染和器械性能下降的风险。
相比较,中国手术室目前较多还在用重复使用的器械。因为重复灭菌的成本和其他风险成本不足以让中国医院去接受一次性器械的价格。

小结
医疗器械投资是一个复杂的工程,对创新技术本身好坏的判断是一个相对程式化的过程。
复杂的是投资人需要考虑社会、法规和人文等一系列环境因素。如果投资人能深入了解这些环境因素,再结合对创新器械技术本身的判断,他们对投资的项目就能有一个全面的分析。
同时,美国的医疗器械五花八门,在将美国医疗器械引入中国市场时,或者投放欧洲或者其他国家、地区时,需要充分考虑地域差异,包括法规、社会制度和保险等。做到有备无患,才能使投资更高效,成功率更高!
参考资料:
https://www.selectusa.gov/medical-technology-industry-united-states
http://www.todaysmedicaldevelopments.com/article/size-and-shape-of-the-us-medical-device-industry/
https://www.trade.gov/topmarkets/pdf/Medical_Devices_Top_Markets_Report.pdf
https://jlabs.jnjinnovation.com/locations/jlabs-toronto
http://www.bhbengineers.com/2013/02/nelson-labs/
http://www.edgesurgical.com/products/
http://www.davincisurgery.com/


本期作者:刘皆宁
毕业于上海交通大学本科,在宾夕法尼亚州立大学获得硕士学位。目前在美国一家跨国医疗器械公司负责业务开发和运营管理。熟悉医疗器械在美国、欧洲和中国市场的研发、生产以及注册。现担任美柏医健研究员。
文章版权归【美柏医健】所有,欢迎转发到朋友圈,转载请联系服务小助手(微信号:BiotoChina)。
投稿或应聘,请将简历发送到
精彩回顾
| 研究类 |
| 访谈类 |
| 资讯类 |

▼ 点击阅读原文,查看最新路演
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。