PD-(L)1药物的发展趋势及市场分析(国内篇) | 美柏研究

随着11月Opdivo进入中国销售的申请得到受理,进口PD-(L)1药物正式登陆中国不再遥遥无期。然而,对于国内的癌症患者来讲,Opdivo约15万美元/年的药物成本,无疑是一笔不小的开支。除了苦苦等待昂贵的进口PD-(L)1药物获批上市,国内的患者还有其他的选择吗?答案是肯定的,目前国内企业在PD-(L)1药物领域的研发可谓是如火如荼,粗略统计已经有20余家企业参与其中,其中的领先者们也许在进口药登陆国内市场之前就可以推出产品。
PD-(L)1药物国内市场潜力巨大
我国抗肿瘤药物中单抗药物比例较低,进口单抗类药物的审批进度较缓慢。
2016年全球抗肿瘤药物总销售额约1000亿美元,单抗类药物占比38%;我国抗肿瘤药物总销售额约340亿元,单抗类药物占比仅为12%,国内对于单抗类药物的需求远未满足。
同时由于我国医疗基础设施相对落后,癌症早期筛查的意识和普及度较低,癌症确诊病例中晚期患者的比例比发达国家要高很多,加上巨大的人口基数,使得针对晚期癌症特效的免疫治疗在国内市场十分巨大。
这为国内研发PD-(L)1的药企带来了巨大的发展空间。
根据德意志银行预测,PD-(L)1在中国的市场总量(治疗所有癌症)在2025年将达到250亿元。主要基于以下假设:
25万元/年的药费;20%的晚期癌症患者接受PD-(L)1药物治疗,其中60%的患者可以负担保险报销后的剩余自负费用;结合国内各癌症的发病人数,晚期癌症诊出率,PD-(L)1的治疗效率等进行综合计算。

点击可查看高清大图

点击可查看高清大图
国内PD-(L)1药企的发展趋势
1. 临床试验适应症兼顾国内市场和国际成果
国内PD-(L)1药物产业虽然起步较晚,但是借助后发优势和政策引导,目前已有多达20家企业参与竞争,在研的PD-1单抗药多达11种,PD-L1单抗药多达5种。
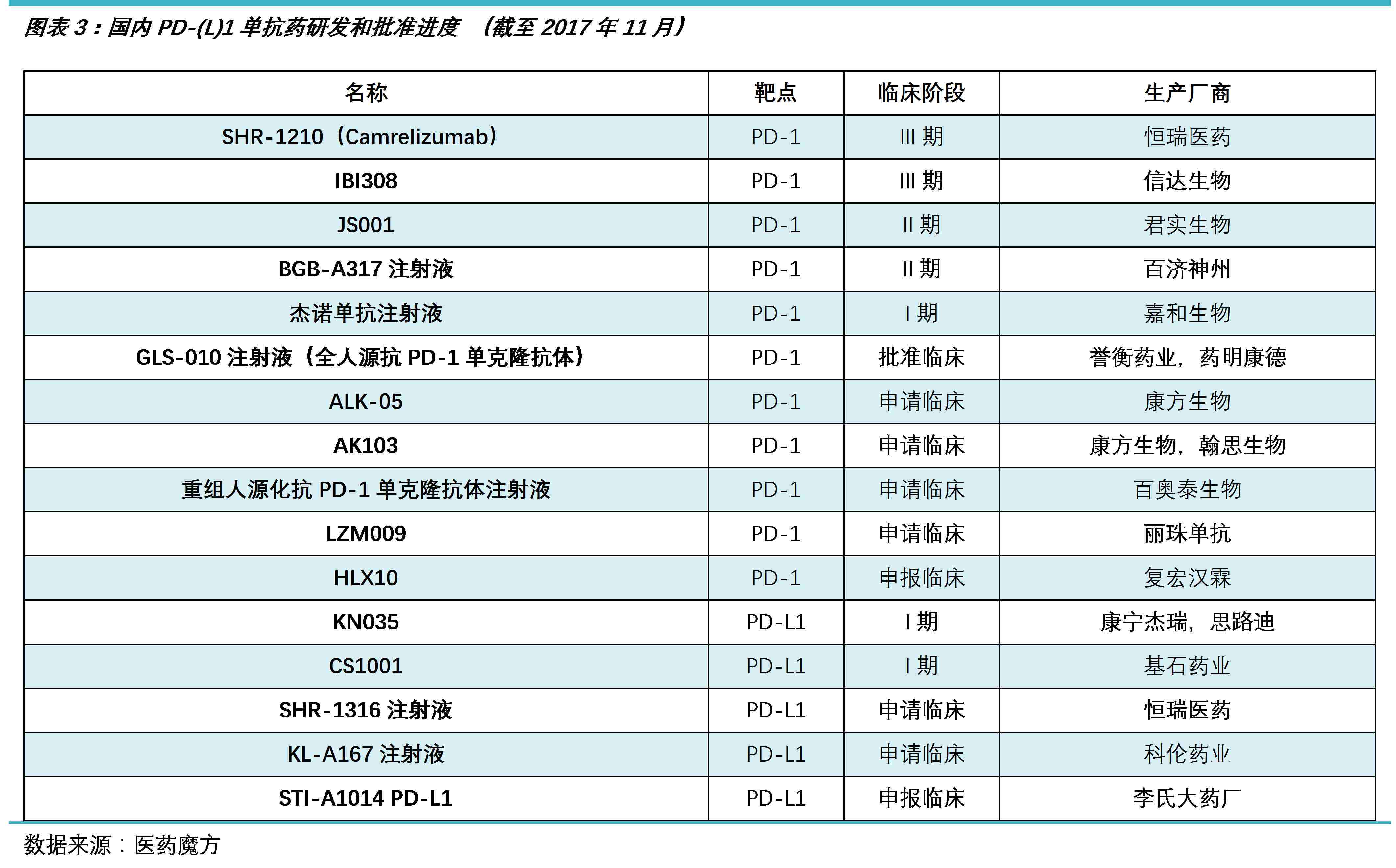
点击可查看高清大图
由于发病机理、环境条件、生活习惯和人种差异等多种复杂因素共同作用,国内癌症的主要种类和发病率与欧美等国存在着较大差异。
以美国为例,与我国常见癌症类型的差别主要体现在,恶性黑色素瘤、膀胱癌和乳腺癌相对高发,而食道癌、胃癌、肝癌发病率相对较低,两国肺癌、直肠癌则都是高发类型。
国内企业目前进行的临床试验适应症主要集中在非小细胞肺癌、食道癌、肝癌等,对国内人群低发的癌症如黑色素瘤则权重较轻。
这样的选择,一方面结合了国际PD-(L)1药物的研发先例,规避研发失败的风险;
另一方面则是根据国内癌症统计数据,开发国内患病率较高的临床适应症,以拓展更为广阔的市场空间,同时临床试验也能更方便的招募受试患者。
目前恒瑞医药、信达生物、君实生物和百济神州在食道癌、胃癌、肝癌方面都已做到临床II期甚至III期。

点击可查看高清大图
2. 联合用药成为临床试验重点方向
在前两期的文章中我们对国际PD-(L)1药物的研发进展进行了介绍,目前PD-(L)1药物的研发重点主要集中在与其他抗癌疗法联合使用,争取一线治疗方案。
同样,现在国内领先的PD-(L)1研发企业如恒瑞医药、信达生物等也都把重心放在联合用药策略上。
除了一线治疗非小细胞肺癌等国外药企进行过密集临床试验的项目之外,针对肝癌、胃癌和食道癌的联合治疗临床试验也在紧锣密鼓地推进当中。

点击可查看高清大图
3. 以阶段性研发成果换取资金和渠道
医药产品的开发是一个高投入高风险的漫长过程,尤其对尚未产生稳定药品销售收入的企业而言,研发后期的财务压力非常明显。
除了利用融资等方式获取现金流之外,以初期研发成果换取资金和销售渠道,是生物制药初创企业降低风险、走向成长比较实际可行的做法。
目前国内几家领先的PD-(L)1药物研发企业都有与国际药企达成合作的成功案例。

点击可查看高清大图
国内PD-(L)1药企的机遇与挑战
单克隆抗体药物作为国家新兴战略产业,得到国家各部委发布多个文件支持。
单抗药物由于价格较高,治疗费用昂贵,尚未进入全国医保目录及基药目录。但在各省的增补目录中,多个单抗增补进入地方医保目录。
近几年国家为提高药品质量、加快药品审批,陆续提出仿制药一致性评价和重点品种优先审评审批等政策。
2017 年6 月,CFDA 正式加入ICH(国际人用药品注册技术协调会),意味着中国药品监管部门、制药行业和研发机构将逐步转化和实施国际最高技术标准和指南,并参与规则制定,推动国际创新药品早日进入中国市场。国际最高技术标准的引入将利好药品质量过硬的优质药企。
与国外巨头相比,国内药企在单抗药领域无论从技术、资金还是产能上都相对薄弱。
以产能为例,国际生物制药产业巨头Genentech单体发酵罐可达25000升,总量达60万升。而目前代表我国抗体生产最高水平的三生国健,仅有3条通过CFDA GMP认证的750升、2条3000升以及符合欧盟标准的6条5000升抗体药物生产线。
然而,随着我国生物医药产业不断成熟,全民健康需求不断提高,国内的优秀药企正在全力追赶国际水平,差距不断缩小。
例如,目前国内PD-(L)1药物研发领先企业之一的恒瑞医药,主营业务中最大的一块就是抗肿瘤药,在抗癌药物领域深耕多年,有丰富的抗癌药物研发经验。
公司原研药阿帕替尼是全球第一个在晚期胃癌被证实安全有效的小分子抗血管生成靶向药物;公司生产的奥沙利铂在2014年就获得FDA许可在美国销售;IDO抑制剂也在最近获得FDA临床试验许可。
公司齐备的抗癌药物产品线为PD-1药物未来进行联合用药试验提供了基础。目前阿帕替尼已经和SHR-1210开始在小细胞肺癌(II期),肝癌(II期)进行联合用药试验。
在产能方面, 另一家PD-(L)1研发领先企业信达生物对下游抗体生产的布局已经开始,其产能目标是与国际药企看齐。
信达生物生产基地预计总投资27亿元,建筑面积9.3万平方米,包括2条1000L(已建成)、4条2000L(建设中,符合CFDA、FDA和EMA的GMP标准)和4条15000L产业化生产线,其中2条1000升生产线已于2016年9月通过了合作方国际制药集团(礼来)的GMP审计。
预计到2025年,信达的生产规模将达到6万升左右,即年产量约1600公斤,产值280 亿元左右。
乐观预计,未来国内PD-(L)1药物研发企业也会像国际市场一样通过资源和技术整合,形成少数几家龙头企业,在多项癌症领域展开良性竞争,并有机会参与到国际市场的争夺中。


本期研究员:徐科锐
本科毕业于北京大学化学系,目前为美国太平洋西北国家实验室博士后,研究方向为癌症细胞蛋白质组,博士期间在美国弗吉尼亚大学研究微流控技术基础应用与产品转化。现担任美柏医健研究员。
文章版权归【美柏医健】所有,欢迎转发到朋友圈,转载请联系服务小助手(微信号:BiotoChina)。
投稿或应聘,请将文章或简历发送到
往期研究

最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。