基因疗法的复兴之路

大约半个世纪前,有远见的科学家们就提出了外源DNA可以用于基因的修复,起到治疗的作用。
2017年,基因疗法取得举世瞩目的成就,为罹患严重和罕见疾病的患者带来了三款上市产品。但是成就背后,基因疗法也遭遇过沉痛的打击。1999年9月13日,在美国宾夕法尼亚大学基因治疗项目中,18岁美国男孩杰西·格尔辛格(Jesse Gelsinger)在接受腺病毒载体注射4天后,因多器官衰竭而死亡。这一事件让人们开始反思对基因疗法的狂热,盲目乐观的态度。
虽然从概念的提出到临床的应用这段旅程是漫长而艰辛的,但是基因疗法已经走上正轨,正在健康快速发展并取得了诸多成就。今天就和大家回顾一下基因疗法的发展和关键性的成功。
从概念到实践:概念的提出到最初的尝试
什么是基因治疗?
可以从两方面理解,一是基因生病了,需要治疗;二是用基因作为治疗手段,去治疗疾病。
基因治疗概念的雏形是在揭示DNA双螺旋结构后形成的。1963年,Edward Tatum 和Joshua Lederberg 提出可利用病毒作为基因转移载体,进行基因纠正和优化。
但这在当年就像现在提出的星球大战概念一样,并没有操作基础。科学家们仍旧在耐心等待技术的发展……
一种新理念的实现,需要一些疯狂的尝试和不断的开脑洞。
1970年,美国医生斯坦菲尔德·罗杰斯(Stanfield Rogers)在对任何基因、基因工程、病毒载体以及疾病机制全无了解的时代背景下,试图通过注射含有精氨酸酶的乳头瘤病毒,尝试治疗一对患精氨酸血症的姐妹。然而,运气没有站在他那边,试验失败了。
尽管这次失败的尝试并未对患者造成伤害,但不得不说这是一次大胆的、冒失的,甚至疯狂的尝试。这也从另一个角度反映了基因治疗的特点,承载着患者绝望中的期盼。
砥砺前行:重大事件回顾
在上世纪70-80年代,随着内切酶、连接酶、反转录酶、病毒载体等分子生物技术工具的开发,基因工程逐渐有了操作的基础。
1980年,美国邮报刊登了一篇文章《医生在两个人身上尝试基因疗法》,加利福尼亚大学洛杉矶分校的马丁·克莱因(Martin Cline)成为第一个在人身上试验基因工程技术的科学家。
1979年,他领导的小组基于钙转的方式,成功把人免疫球蛋白基因导入小鼠的骨髓细胞,用于缺陷小鼠的治疗。次年,他在两名患珠蛋白生成性障碍贫血的病人身上进行尝试;医生从病人身上获取少量的骨髓细胞,并在这些细胞中表达能产生正常血液成分的基因,然后将这些改造后的细胞打回病人体内;这项临床试验没有获得任何机构批准,而且这次尝试失败了。他因此受到了广泛而指责和严厉惩罚,并失去了系主任的职务和NIH(美国国家卫生研究院)的基金。
然而,历史总是充满戏剧性。恰恰是这次失败,加速了基因治疗的进程。
1983年冷泉港会议,讨论的主题从“是否应该发展人类基因治疗”变成“应该如何发展和监管基因治疗的研发,什么时候有可能获得初步的成功”。
到1990年,病毒介导的基因纠正和替代的可行性与有效性,得到了全世界多个实验室的证实。同年,在美国进行了基因治疗史上最早被正式批准的两项人体试验,分别是NIH的威廉·弗伦奇·安德森(William French Anderson)医生领衔的针对重症联合免疫缺陷病(SCID)的基因治疗,以及安德森同史蒂文·罗森堡(Steven Rosenberg)博士合作进行,利用肿瘤坏死因子(TNF)基因修饰的肿瘤侵入性淋巴细胞(TIL)对黑色素瘤进行的免疫治疗。
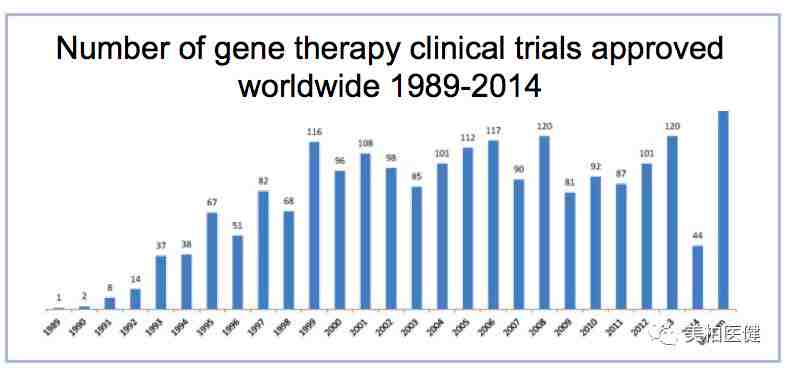
此后,临床试验数量越来越多。到2000年,全球已有4000名患者参与了500多个基因治疗的临床试验项目,基因治疗仿佛就要从实验室真正走入临床应用了。
(Graphs courtesy Alexandra Biffi, Dana-Farber/Boston Children’s Cancer and Blood Disorders Center)
就在其承载着患者希望大步向前的时候,基因疗法日渐膨胀的泡沫被刺破了。
1999年9月13日,在美国宾夕法尼亚大学基因治疗项目中,18岁美国男孩杰西·格尔辛格(Jesse Gelsinger)在接受腺病毒载体注射4天后,因多器官衰竭而死亡。据调查,格尔辛格很可能死于免疫系统对腺病毒载体的过度反应。
这一悲惨事件,让人们再次审视基因治疗的发展之道。基因治疗的开发是一个复杂繁琐的过程,且有关生死,在试验设计和产品审批上应该慎之又慎,切不可因为对名利的追逐而变得激进狂热,也不能因为其所描绘的美好蓝图而变得盲目乐观。
基因疗法最新进展
如今基因治疗的概念得到很大的扩展。凡是采用分子生物学的方法和原理,在核酸水平上开展的疾病治疗方法都可称为基因治疗。随着对疾病分子层面机制的研究和分子生物学新方法的不断涌现,基因治疗方法在21世纪的第二个十年进入了黄金时期。
时至今日,基因疗法可以大致分为三种类型:一是将正确的基因导入细胞来修复细胞缺陷;二是直接修复致病的基因突变;三是近来炙手可热的细胞疗法,在体外对细胞进行基因修改,后注回体内发挥治疗作用。
鉴于CAR-T近来的热度,这里就不过多赘述。小编主要和大家分享前两种基因疗法最新的进展。
基因的突变导致不能编码有功能的蛋白。为解决这一问题,科学家们向这些细胞中导入正常的外源DNA,从而恢复病变细胞的功能。
2014年,FDA授予美国圣地亚哥医药公司Celladon针对心衰的基因治疗药物MYDICAR“突破性疗法”认定。MYDICAR通过腺病毒将SERCA2a酶基因送入心脏,恢复心肌细胞SERCA2a酶的生产并提高心肌收缩。
2015年2月,BLUEBIRD公司正式宣布,他们的LentiGlobin BB305被FDA授予突破性疗法认定为地中海贫血病的基因治疗疗法。地中海贫血是遗传性溶血性贫血疾病。LentiGlobin BB305是利用慢病毒载体,将修正后的β-球蛋白基因导入到由患者体内分离而来的造血干细胞中,然后将这些基因重组的造血干细胞经过扩增再回输至患者体内,以恢复患者正常合成血红蛋白的能力。
2015年10月和12月,安进公司的溶瘤病毒药物T-Vec分别在美国和欧洲获得批准上市,成为第一个被批准的非单基因遗传疾病的基因治疗。Talimogene laherparepvec (T-Vec) 是一种溶瘤免疫疗法(oncolytic immunotherapy)。通过病毒载体表达GM-CSF,注入肿瘤的病毒能够在肿瘤细胞中复制直至细胞膜裂解,同时能够在肿瘤组织局部释放GM-CSF,一种细胞因子,能够激活全身性免疫反应。
2016年7月,基因治疗公司AveXis宣布,FDA已授予其在研新药AVXS-101突破性疗法认定。脊髓性肌萎缩症(Spinal Muscular Atrophy,SMA)是由于存活运动神经元(SMN)基因功能缺失突变导致。AVXS-101通过一次性静脉滴注将腺病毒承载的正常的SMN带入体内,用于治疗 I 型脊髓性肌萎缩症(Spinal Muscular Atrophy,SMA)的儿童患者。不过AVXS-101不是SMA治疗的唯一选项。由美国生物技术巨头百健(Biogen)与合作伙伴Ionis制药公司合作开发的一款罕见病治疗药物Spinraza(nusinersen)于2016年12月底获FDA批准,用于脊髓性肌萎缩症(SMA)儿科患者和成人患者的治疗。Spinraza是一种反义寡核苷酸(ASO),旨在改变SMN2前信使RNA(pre-mRNA)的剪接,以增加全功能性SMN蛋白的生产。
2017年12月,FDA宣布批准Luxturna上市。早在2015年10月,Spark 公司就宣布了针对RPE65的治疗方案SPK-RPE65在第三期临床试验获得成功,将带有 RPE65 基因的腺病毒通过眼底注射的方式注入到患者体内,恢复RPE65 基因在视网膜细胞的作用,从而恢复视网膜细胞的功能。
修复突变基因,是指通过基因编辑的方法纠正致病的基因突变。提到基因编辑,不得不提被誉为“基因剪刀”的CRISPR-Cas9。
CRISPR-Cas系统的低成本,易获取以及可程式化等优越性能正在为生物科学带来一场革命。除了传统的基因敲除和基因插入,它还可以实现精确的基因编辑,大大提高了基因治疗的操作精度。此外,它还是一个强大的全基因组范围内的筛选工具,帮助找到可靠的药物靶点;在发展治疗产品和成为治疗药物本身方面更是拥有巨大的前景。
2017年11月,Nature Biotechnology报道了MIT科学家开发了一种新型纳米颗粒,能够运输CRISPR基因编辑系统,利用纳米颗粒来携带CRISPR组分对小鼠基因进行修改,从而摆脱了基因治疗对病毒载体的依赖。
2017年12月7日,CRISPR Therapeutics宣布提交CTX001在β-地中海贫血中的临床试验申请(CTA),使用CRISPR对患者自身血细胞进行高效精确的编辑,为患有β-地中海贫血和镰状细胞病的患者提供了一次性治疗的可能性。
CRISPR-Cas的另一突破性成就,表观调控基因表达,最近也被研究者尝试运用到疾病治疗当中。CRIPSR-Cas系统对基因的编辑是基于Cas9酶对DNA双链的切割,通过外源导入的模板DNA链对基因进行修改。这种对“源代码”修改的做法总免不了存在一些伦理上的争议。
科学家们将改造后的Cas9与负责基因调控的激活子和抑制子结合起来,开发出一种新型的调控基因表达的工具。来自Salk研究所的科学家们运用这样的技术对肾损伤、1型糖尿病、以及一类肌营养不良的小鼠模型进行治疗,并取得显著成效。
除了导入正确的基因和纠正错误的突变,删除“坏”基因也是基因疗法的策略之一。 接下来我们就看看CRISPR是如何运用到“坏”基因的敲除的。
诺华的Kymriah定价为47.5万美元,约合308万元。Kite的Yescarta,定价为37.3万美元,约合242万元。这种定价引起了很多质疑和批评的声音。目前,大部分的CAR-T疗法都是从患者自身获取T细胞,这是昂贵、耗时的过程。与基于抗体技术的PD-1/PD-L1检查点阻断药物相比,CAR-T从治疗过程和治疗费用都不占优势。如果科学家们能够想办法将这种“私人订制”产品变成通用型的CAR-T细胞,就会大大简化治疗的过程和成本。
移植物抗宿主病(graft-versus-host disease,GVHD)和宿主排斥依然是克服“私人订制”的主要障碍。科学家很早就开始尝试用前CRISPR时代的基因编辑工具ZFN和TALEN去除CAR-T细胞中的内源T细胞受体(TCR)。CRISPR的出现将可以最高效地达到这一目的。
除了产生通用CAR-T细胞之外,CRISPR还能够用于增强CAR-T细胞抑制肿瘤的效率,通过敲除T细胞抑制受体和信号分子,如细胞毒性T淋巴细胞相关蛋白4(CTLA4)或者PD1。NIH重组DNA咨询委员会(RAC)在2016年已经批准了宾夕法尼亚大学的一项临床试验,就是用CRISPR/Cas9敲除针对黑色素瘤细胞的CAR-T细胞中的PD1和TCR基因。
全球首个CRISPR-Cas临床试验在我国四川大学华西医院肿瘤学家卢铀教授研究小组率先开展。不过这一试验只是用CRISPR/Cas9敲除T细胞中的PD1,并没有引入CAR。还有一些类似的PD-1敲除T细胞(PD1-knockout T cells),治疗前列腺癌、膀胱癌和肾细胞癌的试验也在启动中。或许将来CRISPR能直接用于引入CAR。
正是因为CRISPR在基因治疗中巨大的应用前景,诺华制药已经就离体CRISPR技术和多个基因治疗公司(Intellia Therapeutics and Caribou Biosciences)合作,设计更好的CAR-T细胞和血液干细胞。
总结
基因疗法可以说是人类发明的最复杂的“药物”。正是基于学术界众多概念验证性的临床研究,基因疗法正在经历临床和商业的飞速发展。依靠生物技术公司和制药公司在制造和规模化的专长,基因疗法正在从基于学术的“小作坊”模式过渡到工业化研发制造模式,这将对人类疾病治疗带来真正的变革。
2017年可谓是基因治疗元年,这些如雨后春笋般的研发和临床项目,以及一年内三款被批准上市的治疗产品,真正预示着基因治疗的春天到来了。基因疗法正在创造历史,成为人类突破疑难杂症最有希望的武器。
参考资料:
1. Torikai, H., Reik, A., Liu, P.Q., Zhou, Y., Zhang, L., Maiti, S., Huls, H., Miller, J.C., Kebriaei, P., Rabinovich, B., et al. (2012). A foundation for universal T-cell based immunotherapy: T cells engineered to express a CD19-specific chimeric-antigen-receptor and eliminate expression of endogenous TCR. Blood 119, 5697-5705.
2. Torikai, H., Reik, A., Soldner, F., Warren, E.H., Yuen, C., Zhou, Y., Crossland, D.L., Huls, H., Littman, N., Zhang, Z., et al. (2013). Toward eliminating HLA class I expression to generate universal cells from allogeneic donors. Blood 122, 1341-1349.
3. Hoos, A. (2016). Development of immuno-oncology drugs from CTLA4 to PD1 to the next generations. Nature reviews Drug discovery 15, 235-247.
4. Cyranoski, D. (2016). CRISPR gene-editing tested in a person for the first time. Nature 539, 479.
5. https://zhuanlan.zhihu.com/p/25298581
6. https://www.washingtonpost.com/archive/politics/1980/10/08/doctor-tried-gene-therapy-on-2-humans/c95d4b44-3e5c-4a48-904c-4bbefe52391b/?utm_term=.09aec6185a0b
7. Yin, H., et al., Structure-guided chemical modification of guide RNA enables potent non-viral in vivo genome editing. Nat Biotechnol, 2017. 35(12): p. 1179-1187.


本期作者:李笠
中国农业大学分子生物学博士,目前为美国贝勒医学院博士后,从事乳腺肿瘤转移机制研究,对癌症早期靶点筛选以及相关药物开发有浓厚兴趣。博士期间研究哺乳动物体细胞克隆以及在克隆动物中用shRNA抑制病毒复制。美柏医健研究员。
文章版权归【美柏医健】所有,欢迎转发,转载请参照“转载须知”。
投稿或应聘,请将简历发送到
精选内容
美柏路演

▼ 点击阅读原文,查看更多好内容
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。