J.P.摩根2018: 基因治疗继续高歌猛进,新贵“蓝鸟“即将展翅高飞 | 美柏快讯


近期召开的2018年J.P.摩根健康产业大会上,蓝鸟生物公司雄心勃勃,宣布将在2019年底之前提交3个新药注册审批申请。该公司以其在CAR-T细胞疗法领域出色的临床研究而名噪一时,但到目前为止还没有产品上市。如果申请的产品获批,无疑将帮助蓝鸟成功转变为一家冉冉上升的商业公司。
第一个期待提交申请的将会是早前获得FDA突破性疗法认定的基因治疗药物LentiGlobin。 蓝鸟将在今年为LentiGlobin用于输血依赖性β 向欧洲药品管理局提交申请。其他两个产品包括用于脑肾上腺脑白质营养不良治疗的基因治疗药物Lenti-D和用于多发性骨髓瘤的CAR-T疗法bb2121,申请也将在2019年底之前完成。
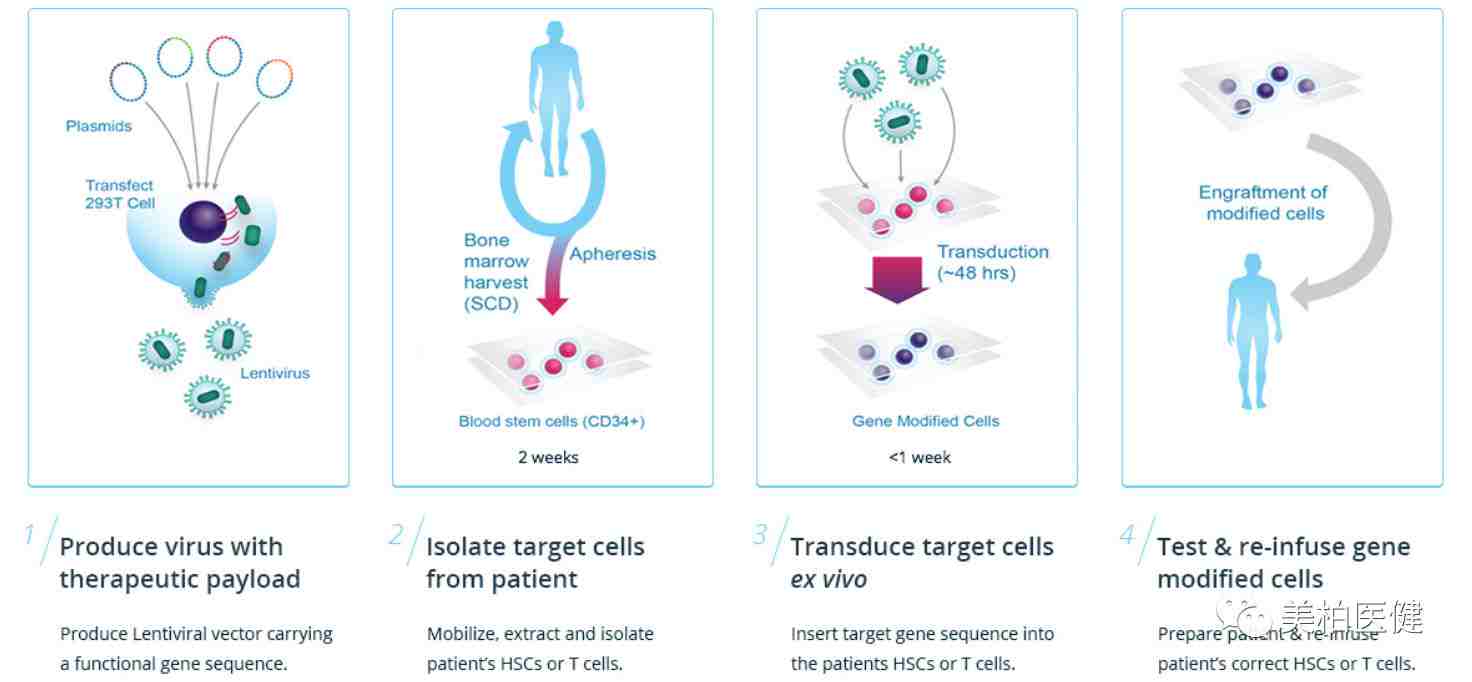
基因疗法流程
在2017年12月举行的ASH会议上,蓝鸟生物报道的CAR-T疗法bb2121用于晚期复发难治多发性骨髓瘤治疗的一期临床试验结果引起轰动。和已经获得FDA认证的CAR-T不一样,bb2121是一种新的BCMA靶向治疗。
在兼顾安全性的同时,94%的病人实现了客观缓解率,至少89%的病人实现了很好的部分缓解。出色的结果让业界对bb2121普遍看好,认为该疗法有望成为针对多发性骨髓瘤的重要疗法,攻克这个曾经的不治之症。
在上述三个产品之外,蓝鸟生物同时在开发用于镰状细胞贫血的基因疗法,公司会在今年年底公布临床研究进展。
资料来源:
- https://www.biospace.com/article/unique-ambitious-bluebird-seeks-three-drug-approvals-by-2019/
- https://endpts.com/bluebird-will-ask-for-3-drug-approvals-by-2019-including-car-t-and-gene-therapies/


本期作者:Sharon Chen
本科毕业于北京大学,现南加州大学药学博士在读,主要从事CAR T细胞疗法用于实体瘤治疗的研究。目前担任美柏研究员。
文章版权归【美柏医健】所有,欢迎转发,转载请参照“转载须知”。
投稿或应聘,请将简历发送到
美柏资讯

▼ 点击阅读原文,查看更多好内容
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。