新药研发争分夺秒,如何抢占这一绿色通道?7年梳理,看清规律和趋势


新药开发就是一场争分夺秒的竞赛。时间,至关重要。对患者而言,时间就是生命;对制药企业和投资人而言,时间就是金钱。
如果在这场比赛中加入一条绿色通道,获得青睐的种子选手不仅有高效捷径可走,还有裁判亲自下场指导完成比赛,那岂不美哉?在现有的美国FDA监管的新药开发框架下,就有一条这样的途径——突破性疗法认定。
突破性疗法认定是什么?它对药物研发企业和医健投资又有怎样的意义?2018年有那些获得突破性疗法认定的新药值得关注?接下来我们为您一一解读。
什么是突破性疗法认定(Breakthrough Therapy Designation)?
突破性疗法认定通道由FDA于2012年7月设立,旨在促进用于治疗大病以及疑难病的新药开发。总体而言,申请突破性治疗认定的药物须同时满足两个条件:
1. 单独或与其他药物联合,来治疗严重威胁患者生命安全的疾病;
2. 在一个或多个重要的临床终点指标上,有充足的临床早期数据证明在研药物与现有治疗方式相比有根本性地突破。
作为继快速通道(Fast track)、加速批准(Accelerated approval)、优先审评(Priority review)之后的又一个新药评审绿色通道,获得突破性药物认定的药物,在开发过程中会得到FDA密切的指导,协助制定快速有效的临床试验方案。
同时,在新药审批环节,如果临床研究结果积极,已获得突破性疗法认定的药物,还常常会被额外授予优先审评资格和/或加速批准,可谓是得到FDA全方位的保驾护航。
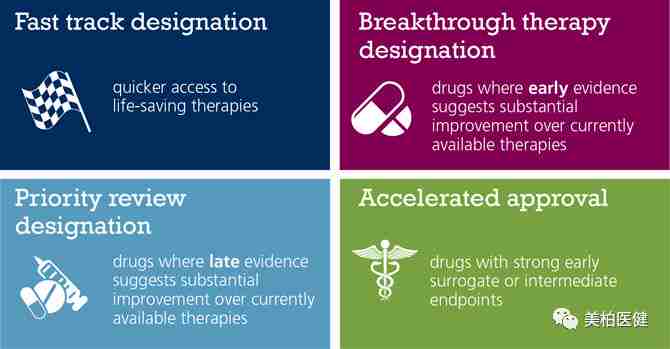
▲ 四种FDA新药审评绿色通道比较
突破性疗法认定三大趋势
针对过去7年突破性疗法认定的总体情况,我们总结出这条路径的三大趋势:
在设立后的7年时间内,突破性疗法认定获得了产业界、研究机构和病人团体的一致认可,加速了很多重大创新药物从临床研发到批准上市的过程。产业界申请突破性疗法认定的热度一路走高,FDA通过的突破性疗法数量也在逐年递增,2016、2017年均超过30个。2018年1月至今,FDA已经授予10个突破性疗法认定。
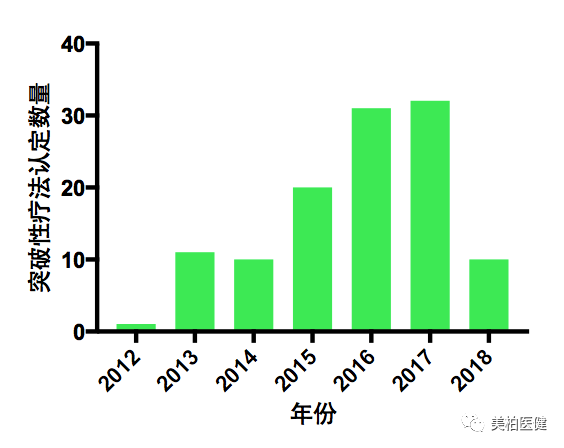
▲ 每年FDA授予的突破性疗法认定数量
(数据来源Friends of Cancer Research)
在目前授予的突破性疗法认定中,有接近一半是抗肿瘤药物治疗。其中有近年大出风头的抗肿瘤免疫细胞疗法,也有多个新型靶向小分子药物。其他主要适应症包括罕见遗传性疾病、感染性疾病和心血管疾病等,呈现出多样化的特点。
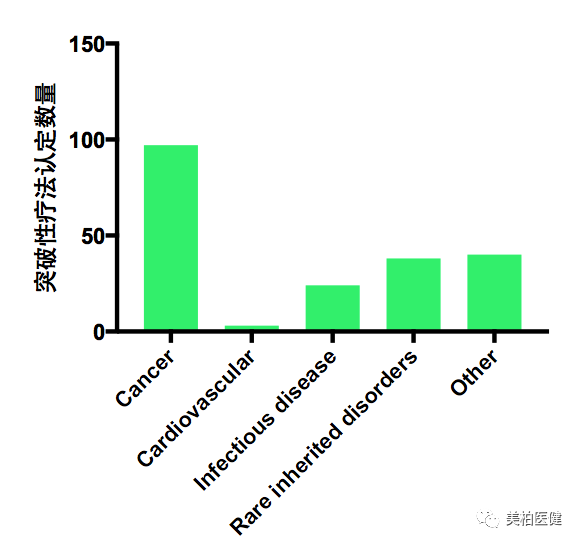
▲ 突破性疗法认定治疗领域分布
(数据来源Friends of Cancer Research)
在设立的最初几年,享受到突破性疗法认定的主要群体是制药巨头和大型生物科技公司。
基于指导和帮助资金有限的中小型公司开发新药的初衷,FDA近年来逐渐重视对中小型公司授予突破性疗法认定,如Omeros开发的治疗免疫球蛋白A肾病的药物OMS721,Sage Therapeutics开发的治疗重度抑郁症的药物SAGE-217。
虽然大公司被授予的突破性疗法认定数目更多,但分析人士认为获得突破性疗法认定对小公司产品开发而言意义更为重大。
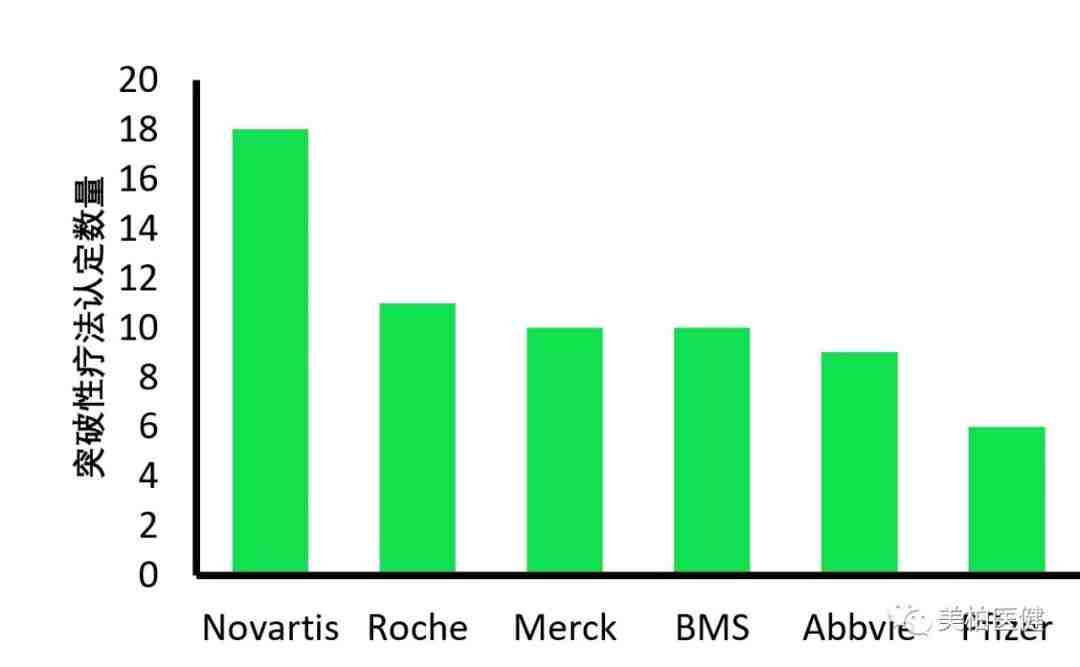
▲ 获得最多数量突破性疗法认定的6个公司
(数据来源Friends of Cancer Research)
突破性疗法认定的积极影响
那么,突破性疗法认定对在研药物和研发企业有怎样的积极影响呢?突破性疗法认定和普通临床认证会有哪些不同?
《美国食品药品管理局安全和创新法案》(FDASIA) 第902条规定,一旦药物获得突破性疗法认定,FDA应当采取措施加速药物的开发和评审工作,包括:
- 在整个药物开发阶段,与临床研究发起人和评审小组进行多次会议沟通
- 对研究发起人适时地提出建议,以保证药物开发计划中的临床前/临床研究数据收集工作切实高效地进行
- 在保证结果科学性的前提下,采取措施优化临床试验设计
- 为FDA评审小组任命跨学科的项目领导,协调评审小组各学科成员的内部互动,以及通过评审部门的项目经理和研究发起人进行沟通
- 召集资深管理人员和评审人员来协作跨学科评审工作
这一系列规定明确了FDA在突破性疗法认定药物开发过程中的指导和协助作用,为公司减少临床试验的时间和金钱投入、提高临床研究效率创造了可能。
2016年,有癌症宣传组织对FDA加速审批程序对癌症药物开发周期的影响进行了调查,发现突破性疗法认定使该类药物的开发周期平均缩短了2年以上。这主要是因为拥有突破性疗法认定的药物的上市前开发所需时间更短,从递交临床研究申请到新药申请,该类药物需要5.2年,而普通药物需要7.4年。
同时,获得突破性疗法认定的药物几乎都可以享有优先审评资格和加速审批资格,相较于普通药物,其批准时间通常还会提前3个月。
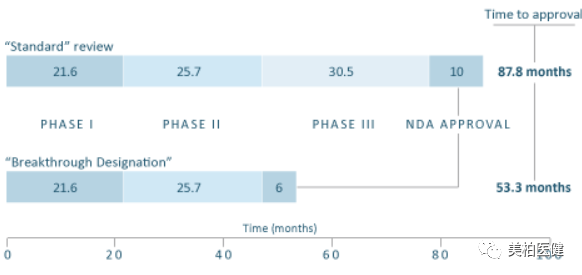
▲ 普通药物和突破性疗法认定药物开发周期比较
根据“癌症研究之友”(Friends of Cancer Research)网站的研究数据,自2012年以来,获得FDA突破性疗法认定的药物共计21个,其中85个药物已经获得批准。除2个药物被取消认定外,其余药物的临床试验均还在进行中。由此我们可以看出获得突破性疗法认定意味着新药申请获批概率有望大幅度提升。
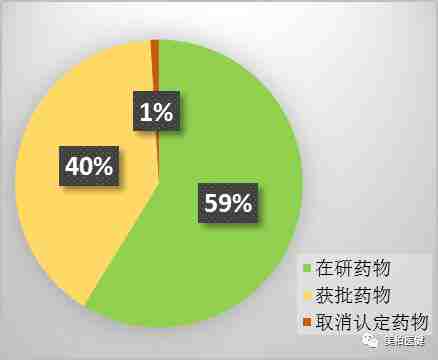
▲ 突破性疗法认定药物获批比例
(数据来源Friends of Cancer Research)
由于突破性疗法认定需要初步临床试验证据表明研究药物与现有治疗药物相比,在一个或多个临床有意义的终点上有实质性改善,而且许多突破性疗法认定药物在被批准后成为了针对其适应症的一线治疗方案。
因此,在研的突破性疗法认定药物,也往往被认为会具有良好的治疗效果和开发前景。
这种良好的产品形象首先可以在短期内为公司吸引更多的投资,帮助提升公司的价值;其次,可以帮助公司在临床试验阶段更容易招募到受试患者,缩短临床研究周期;最后,可以在研发阶段带给产品很高的社会关注度,有利于产品上市后快速获得患者认可并占领市场。
突破性疗法认定加速药物开发有一个经典的例子,罗氏的抗肿瘤药物艾乐替尼(Alectinib)。
该药物在2013年9月凭借良好的早期临床数据获得第一次FDA突破性疗法认定,用于治疗接受克唑替尼(Crizotinib)疗法后症状继续恶化的ALK阳性非小细胞肺癌患者。两年之后获得优先评审资格,并在3个月内被FDA批准上市。上市后继续进行的III期临床试验显示,与标准疗法克唑替尼相比,有更好的疗效和更少的毒副作用。2016年10月,FDA第二次授予了它突破性疗法认定,并在一年之后,批准艾乐替尼用于治疗ALK阳性非小细胞肺癌。
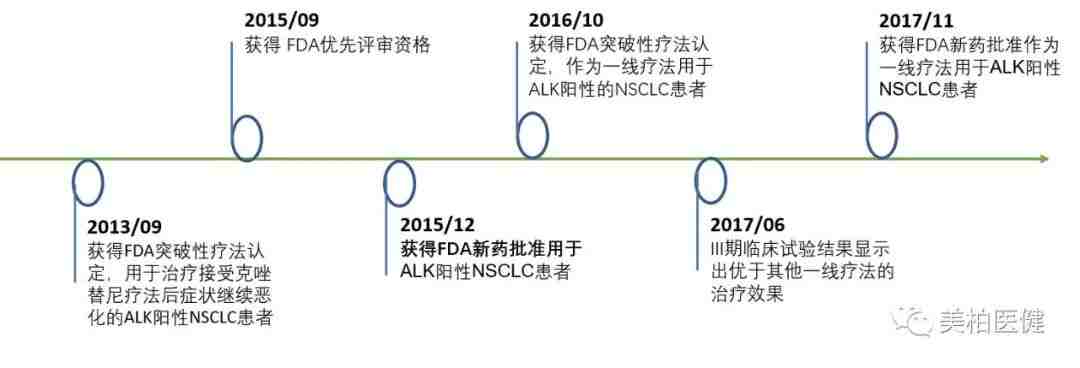
▲ 艾乐替尼临床研发时间线
2017年6月更新的《NCCN非小细胞肺癌临床实践指南》正式确立艾乐替尼为ALK阳性非小细胞肺癌患者的一线疗法,推翻了克唑替尼长期在这个领域的霸主地位。艾乐替尼2016年销售额为1.84亿美元,预计未来五年能达到9亿美元。
从第一次突破性疗法认定到被FDA批准上市,艾乐替尼用了两年;从第二次突破性疗法认定到第二次作为一线疗法上市,临床开发和审批时间缩短为一年。艾乐替尼是罗氏和FDA通力合作进行药物开发的成功案例,其成功上市创造了公司、监管部门、患者群体三赢的局面。

▲ ALK阳性非小细胞肺癌患者的一线治疗药物艾乐替尼
2018年开年至今,FDA已授予10个突破性疗法认定,其中最受关注的药物莫过于Sage Therapeutics开发的针对重度抑郁症的药物SAGE-217。
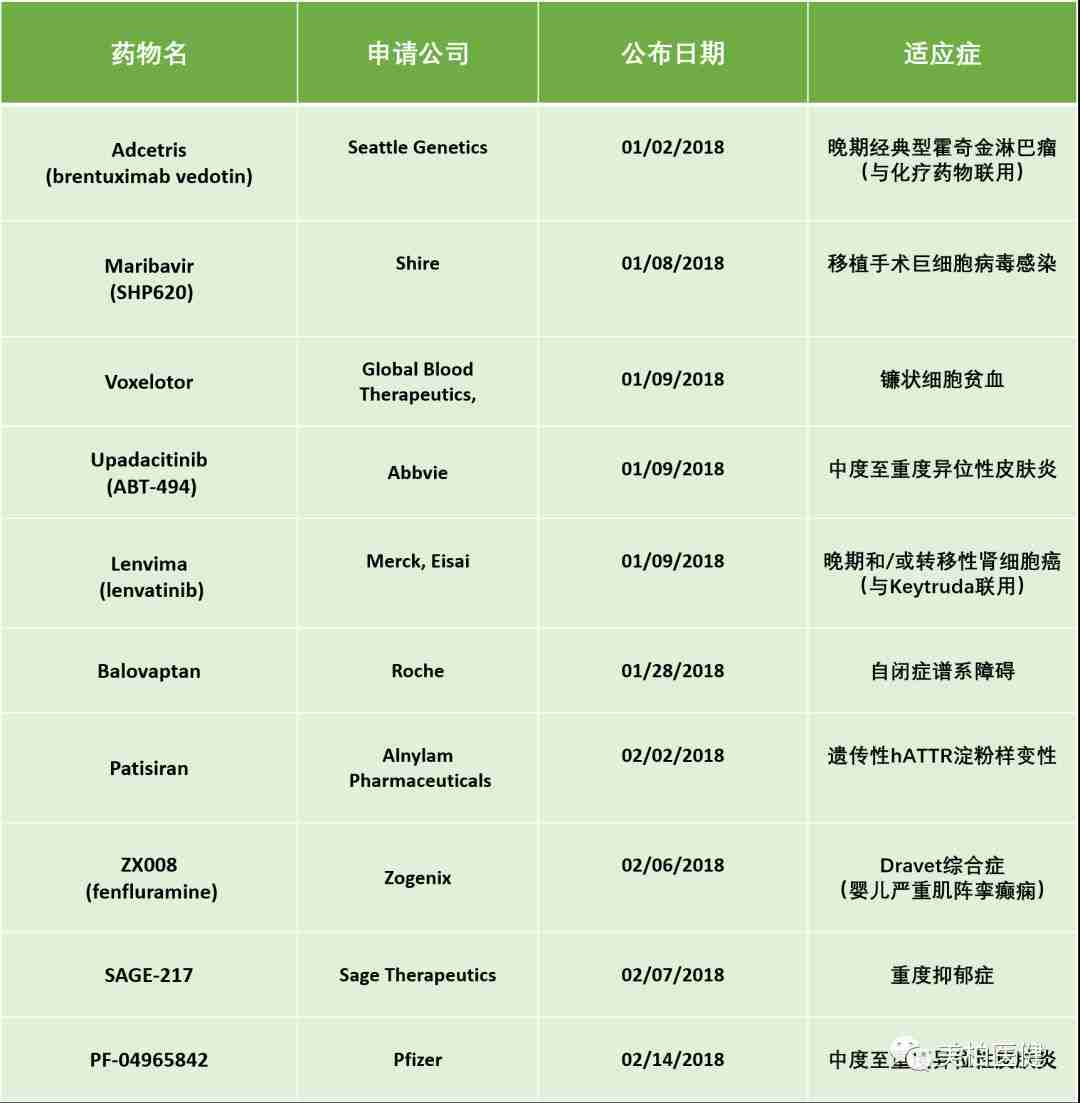
▲ 2018年(截至2月14日)获得突破性疗法认定药物名单
(数据来源Friends of Cancer Research
SAGE-217是一种新型高效高选择性GABAA受体正向变构调节剂,作为口服日用疗法治疗多种中枢神经系统障碍疾病,如原发性震颤(II期临床)、帕金森病(II期临床)、产后抑郁症(II期临床)、等。2017年12月公布的临床试验结果显示,SAGE-217在89例中度至重度抑郁症成年患者中表现出积极治疗结果和较好安全性。
过去二十年间,抑郁症治疗领域一直没有重大创新,有尚未满足的重大医疗需求,Sage Therapeutics认为SAGE-217有望成为抑郁症提供新的治疗思路,实现快速、耐受良好和持久缓解的治疗作用。

▲ 专注中枢神经系统障碍药物开发的生物医药公司Sage Therapeutics
2018年2月,FDA授予SAGE-217突破性疗法认定用于重度抑郁症治疗,这无疑将大大该药物的后期临床开发。结合SAGE-217针对其他疾病的临床试验数据分析,这种GABAA受体调节剂可能会影响多种疾病机制,具有广阔的开发前景。
结语
虽然突破性疗法认定前进的过程中也伴随着质疑的声音,认为在此途径中的临床研究数据和加速审批环节不能完全保证获批药物的疗效,但FDA从来没有停止对细节的完善和对流程的优化。
7年的实践硕果累累,突破性疗法认定用一个又一个为患者带来治疗转机、为制药企业带来丰厚利润的产品证明了其存在的意义,其经验值得其他国家借鉴,其价值值得医药领域的投资者重视。
参考资料:
1. https://www.focr.org/breakthrough-therapies
2. https://www.fda.gov/RegulatoryInformation/LawsEnforcedbyFDA/SignificantAmendmentstotheFDCAct/FDASIA/ucm329491.htm
3. https://www.raps.org/regulatory-focus™/news-articles/2016/3/analysis-breakthrough-therapies-cut-development-timeline-by-two-years
4. Sherman, Rachel E., et al. "Expediting drug development—the FDA's new “breakthrough therapy” designation." New England Journal of Medicine 369.20 (2013): 1877-1880.
5. Shea, Michael, et al. "Regulatory Watch: Impact of breakthrough therapy designation on cancer drug development." (2016): 152.
6. Aggarwal, Saurabh Rob. "A survey of breakthrough therapy designations." Nature biotechnology 32.4 (2014): 323.


本期作者:Sharon Chen
本科毕业于北京大学,现南加州大学药学博士在读,主要从事CAR T细胞疗法用于实体瘤治疗的研究。目前担任美柏研究员。
文章版权归【美柏医健】所有,欢迎转发,转载请参照“转载须知”。
投稿或应聘,请将简历发送到
精选内容
美柏路演

▼ 点击阅读原文,查看更多好内容
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。