【高分论文深度解读】董波/陈凯/冷梁团队联手利用进化节点动物,探索胚胎早期发育调控机制的最新研究
把解螺旋 设为星标 ⭐,才能准时收到推送哦~
解螺旋公众号·陪伴你科研的第3608天
不同物种的胚胎发育模式多种多样,但合子基因组激活(zygotic genome activation ,ZGA) -从转录沉默的受精卵到与早期发育基因活化并行的看家基因重新激活-是一个高度保守的事件。这一阶段在动物进化中受到很强的选择约束,任何调控异常都可能导致生物出现显著不适应性和发育异常。所以,科学家们一直在探寻着ZGA的发生机制。
不同物种的合子基因组激活过程
2024年3月16日,由中国海洋大学、昆明理工大学、成都中医药大学研究人员组成的联合团队在Nature Communications(IF=16.6)上发表了一篇有关ZGA的时空动态及等位基因特异性表达机制的论文。
研究人员巧妙地利用进化远缘的两种海鞘构建了一个能够观察到严格意义上看家基因重新激活以及父母本差异性表达的合子基因的体系,通过常规转录组测序、单细胞测序、CUT&Tag等技术,揭示了处于重要进化节点尾索动物的合子基因组激活的时空动态模式,为深入认识动物合子基因组激活的调控机制及演化历程提供了重要科学参考,也为非经典模式生物开展进化发育生物学研究提供了新的思路和新的视角。
此外,这篇论文也被收录到Nature 集团出版的"Developmental insights from non-traditional model organisms”专辑中。专辑编辑认为该项工作将成为他们感兴趣的利用非模式生物研究发育学问题的一个范例(“It will be among the first included and will serve as a great example of the kind of work we are interested in.”),并邀请作者团队向该专辑进一步投稿。
论文标题
Temporospatial hierarchy and allele-specific expression of zygotic genome activation revealed by distant interspecific urochordate hybrids(远缘尾索动物种间杂交揭示合子基因组激活的时空层次和等位基因特异性表达)
作者介绍
研究背景
在受精后,早期卵裂主要依赖母源蛋白与RNA,而受精卵本身基因组处于静默状态。随着胚胎发育,早期发育基因开始转录,同时看家基因也重新表达,这个过程称之为合子基因组激活,是早期发育的保守过程,并推进胚胎发展。理解ZGA及基因等位特异性表达(Allele-Specific Expression,ASE)的机制,对揭示胚胎发育调控至关重要。现有相关研究集中在模式生物上且假说存在不足,故来自中国海洋大学、昆明理工大学、成都中医药大学研究人员们希望通过对进化节点生物海鞘的研究来揭秘ZGA和ASE的发生过程.
现有的合子基因组激活的四种模型
研究发现
研究人员发现他们实验室常用的两个海鞘物种(Ciona robusta和C. savignyi)在进化上分歧甚远(约1.2亿年)但依然能在实验室通过酶去除卵膜从而实现杂交并发育至幼虫,杂交胚胎因父母本基因序列差异巨大,可以作为天然遗传标签进行父母本基因的区分,为研究合子基因组激活表达提供了一个独具特色的理想研究系统。为非经典模式生物开展进化发育生物学研究提供了新的思路和新的视角。国际同行对此项工作给予了高度评价,“作者建立了一个灵敏而高效的系统在海鞘胚胎中研究合子基因组激活”(“Dong and colleagues present a very astute and powerful model system to characterize the maternal to zygotic activation in ascidian embryos.”)
临床意义
尽管这项研究是在海鞘这一特定生物模型中进行的,其结果对更高等生物早期发育的基因调控机制有重要的启示作用。具体来说,合子基因组的调控过程不仅是进化发育领域的一个基础科学问题,同样是人类生殖健康的前沿方向。研究揭示了在早期发育过程中细胞命运如何与ZGA的时空模式联系在一起,这有助于科学家们理解胚胎如何在为期短暂的精密调控下发展形成复杂的多细胞生物体。此外,通过研究等位基因特异性表达的机制,科学家们能够对遗传病及其表型变异的成因有更深的理解。
实验策略
研究团队开发了深度分化(分化约1.2亿年)的两个海鞘物种之间的杂交体系,以对ZGA动态进行记录。
首先,使用双向的杂交策略来评估两物种杂交胚胎发育能力,并通过Illumina NovaSeq system进行普通转录组测序(bulk RNA-seq)和单细胞RNA测序来检查表达谱。此外,还进行了CUT&Tag实验、整体原位杂交、细胞刚度测定等对ZGA的时空动态进行研究。最后,研究团队研究了在ZGA过程中等位基因表达的偏好性及其调控机制。
结果解读
1. 两种深度分化的Ciona属海鞘杂交体胚胎的发育能力
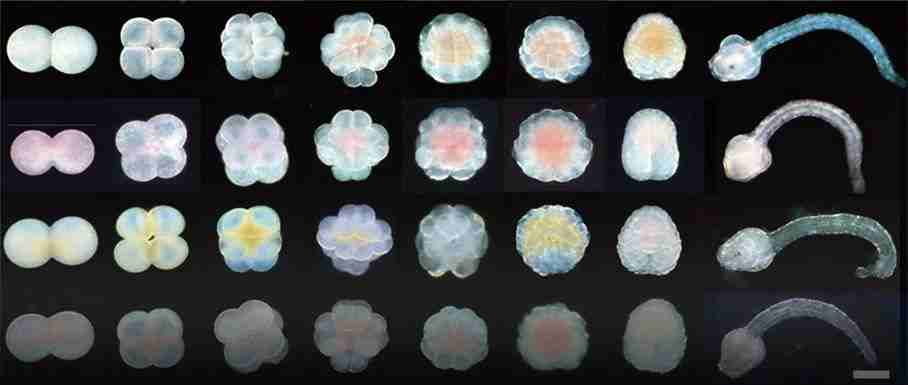
Figure 1. 从两种不同遗传学上差异较大的Ciona海鞘生成杂交个体和基因表达谱
a)成年C. robusta(左侧)和C. savignyi(右侧)的形态学对比。
b)Ciona属物种的进化树和分化时间。C. robusta和C. savignyi的分离时间约为1.22亿年前,这个时间比任何两个现存有胎盘的哺乳动物的分离时间都要长。
c)四种交配组合海鞘的不同发育阶段。显示了自交和杂交个体的八个发育阶段,涵盖了从2细胞阶段开始到尾芽阶段的发育过程。图像表明了即使正向杂交(C. savignyi♀ ×C. robusta♂)和反向杂交(C. robusta♀ ×C. savignyi♂)存在着早期神经胚阶段发育失败率的差异,但在尾芽阶段之前的胚胎形态和时间上并无明显区别。
d)基因表达谱策略概述。这个研究使用普通转录组测序(Bulk RNA-seq)分析了正向和反向杂交胚胎在从1细胞到晚期神经胚(late-neurula)阶段的基因表达概况。此外,还在64细胞、112细胞和早期神经胚胎阶段收集交叉胚胎进行单细胞RNA测序。
为了可以清晰分辨来自父本和母本的基因,研究人员选择了形态相似但遗传差异较大的两种海鞘作为亲本。通过去除卵膜以促成两者之间进行杂交,并在多个关键时期观察其胚胎发育以及分析基因表达差异。通过这一系列步骤,研究团队准备揭示胚胎早期发育中基因组激活的动态特性。
2. 杂交海鞘胚胎合子基因组激活的时间动态
Figure 2. 海鞘胚胎发生过程中 ZGA 的两个协调波
a) 对于每个发育阶段的RNA序列数据,将读取的序列映射到C. robusta 和 C. savignyi 的基因组上。从 8 细胞阶段开始,映射到父本基因的读数均匀增加。
b) 详细呈现了随着发育阶段从 1-cell 到late-neurula阶段的父本基因的读数比率相对于所有基因的读数比率的变化趋势。父本基因在早期胚胎阶段(1-、2- 和 4-细胞阶段)中的转录较少,大多数读数映射到了母本基因上。但从 8-细胞阶段开始,父本基因转录物开始被检测到,并且其比例在后续的发育过程中逐渐增加。
c) 不同发育阶段中新转录的父本基因数目相对于所有父本基因的比例变化趋势。在基因表达的启动和看家基因的重新激活对应的ZGA波段,新转录的父本基因比例都发生了陡增。
d) 使用CUT&Tag技术得到的H3K27ac信号热图。在反向交叉胚胎中,64-到112-细胞阶段中 H3K27ac 信号显著增强。
e)和f)是正向和反向杂交胚胎中父本基因表达的热图。显示了两个主要的表达波段的协同调控关系。
通过RNA测序等转录组学分析,揭示了两个ZGA轮次的存在,一个早期轮次(16-到32细胞阶段)和一个主要轮次(64-到112细胞阶段),这两轮显示了早期基因启动和看家基因的重新激活。此外,通过CUT&Tag技术的H3K27ac修饰分析支持了RNA-seq结果,并且强调了父母本看家基因激活在染色质状态中的动态变化类似且与检测到的副本转录是一致的。这些发现揭示了ZGA在海鞘胚胎发育中具有协同调控关系的特点及其潜在的调控机制。
3. 单细胞转录组揭示合子基因组激活的空间不同步模式
Figure 3. 单细胞转录组揭示看家基因重新激活
a) & d) 正向杂交胚胎的 64 细胞(a)和112细胞(d)的 UMAP 图。通过将已知的基因表达模式与这些簇对齐,研究人员标注了这些簇的身份,包括内胚层、脊索细胞、间质、肌肉、神经绳、生殖细胞、神经和表皮。
b) & c) 父本家族基因转录比率(64-细胞阶段)图。计算了64细胞时期在不同细胞类型中父系家庭基因与所有基因的转录比例。研究结果表明,内胚层细胞有最高的父系转录比例,其次是脊索细胞。
e) & f) 父本家族基因转录比率(112-细胞阶段)图。在112细胞阶段,内胚层和脊索细胞仍是父系转录比例最高的细胞群。
g) 原位杂交验证:通过全胚原位杂交技术验证特定父本家族基因在前向交叉胚胎的不同发育阶段(32、64和112细胞阶段)中的转录活动。
通过结合单细胞RNA测序数据的深入分析与原位杂交技术,提供了在细胞层面对ZGA空间异质性的一瞥,揭示了不同细胞类型间父本家族基因重新激活的异速性,展示了复杂的细胞命运决定和合子基因组激活,尤其是看家基因的重新激活,调控的交织。这些发现对于我们理解早期胚胎发育中基因表达如何被精确调控,以及这些机制如何与细胞命运分化相关具有显著意义。
4. 合子基因组激活过程中物种偏好性的等位基因激活
Figure 4. 杂交动物胚胎发生过程中等位基因的激活
a) 是特定发育阶段的基因表达热图。展示了在从112细胞阶段到晚神经管阶段的发育过程中,父源和母源基因在杂交胚胎中的表达差异。b) 是基因表达倾向象限图。分类和可视化基因对是C. robusta表达优势、C. savignyi表达优势,还是父母基因表达优势。a) & b)都表明在晚期表达基因中物种显性,大于亲本显性。
c) 等位基因激活的验证:通过检测H3K27ac修饰和RNA聚合酶II的CUT&Tag实验数据,研究者比较了C. robusta和C. savignyi的titin等位基因早期神经管阶段的表达模式。
d) 启动子活性测试:通过分析拼接的向量和正常的启动子区域,研究者测试了来自C. robusta和C. savignyi的titin启动子的活性。实验结果显示,C. robusta的启动子在早期神经管阶段有信号表达,而被替换了调控元素序列的启动子也呈现出了特定的表达活性。这些结果支持了启动子活性与等位基因表达偏向是由基因序列和调控元素的差异导致的这一假设。
在杂交海鞘胚胎发育过程中,由于父母双方基因组差异而导致了基因的特异表达模式,即ASE(allelic-specific expression,等位基因特异表达)。这些发现有助于了解等位基因特异表达的分子基础以及这些表达模式是如何由基因组中的特定序列差异所驱动的。这些信息对于理解在胚胎早期发育过程中,基因表达是如何在不同的物种间进行调节的具有重要价值。
主要结论
1. 杂交体系能够有效的揭示被囊动物(也称尾索动物)两轮保守的合子基因组启动过程,其中看家基因的重新激活和第二轮发育基因的活化是同时进行。
2. 被囊动物的ZGA不遵循传统的自然时钟模型或核质比(N/C比)模型,而是和细胞谱系分化、细胞命运有关。
3. 物种特异性等位基因激活在ZGA过程中占据了主导地位,并可能与两个物种间顺式调控元件的差异有关。
延展讨论
本研究创造性地使用两种深度分化(约1.2亿年)的海鞘物种制作的杂交体来进行ZGA研究。这两种海鞘几乎所有的看家基因都存在15%左右的不同之处,确保了杂交体中观测到的看家基因表达来源的准确性,实现对每个细胞每个谱系都能检测到严格意义上的看家基因启动,保障了研究的时间解析度。研究人员也证明了想要探寻科学奥秘不一定需要等到新一代更加有针对性的技术出现才能实现,有时候换一个角度用相对简单的方法去构建全新的模型也许就能更加快速且明晰的实现研究目标。
同时利用单细胞测序,实现ZGA的层级性和动态性描绘。研究发现ZGA在16到32细胞阶段发生第一波激活,在64到112细胞阶段发生第二波主要激活。
研究结果提示,ZGA的时机既不与经过的时间一致,也不符合N/C比率模型,而是由细胞命运决定,并与细胞刚度相关。ASE的效应在物种层面而非父母层面发生,可能是由于两物种间调控元件的分化造成的。这些发现为理解ZGA特别是保守的基因重新激活这一关键发育过程的调控策略提供了系统。考虑到海鞘是脊椎动物最近的无脊椎动物亲戚,这项研究还为理解动物演化过程中调控这个关键发育过程的策略提供了一个独特的系统。
—END—
最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。