人类祖传发动机设计与维修艺术丨混乱博物馆



-文字稿-



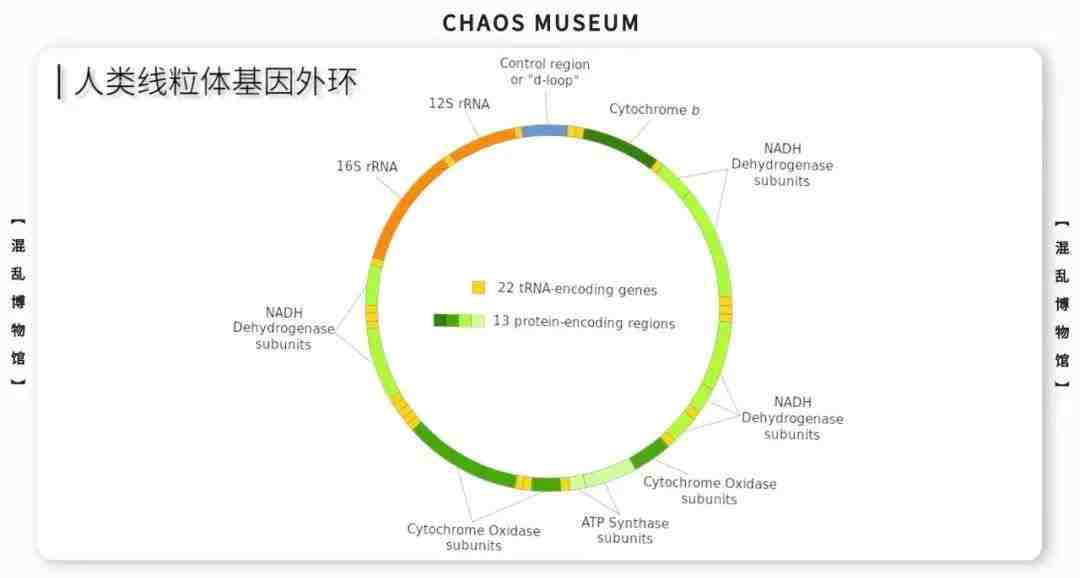
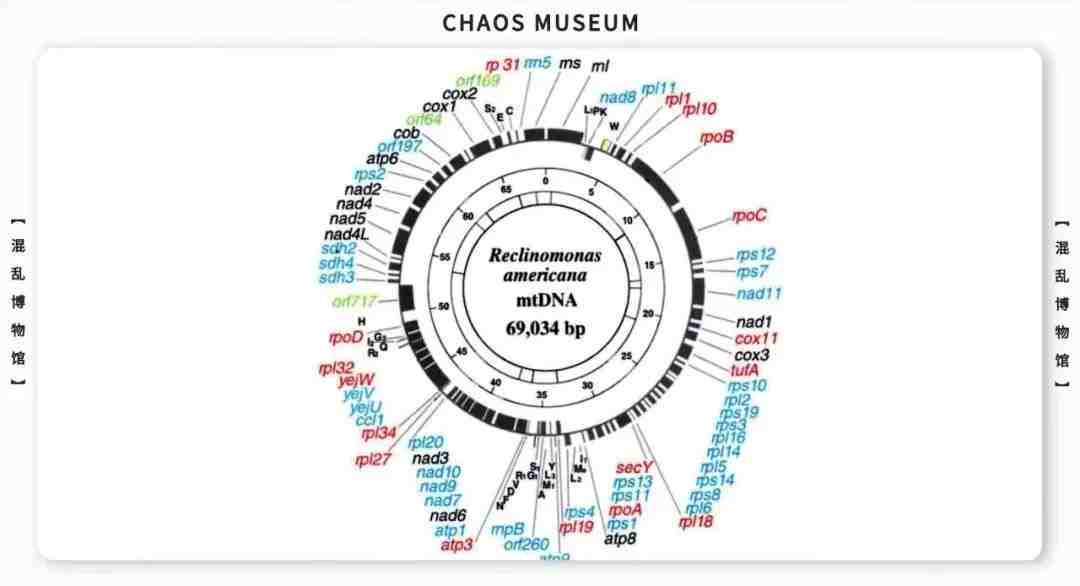

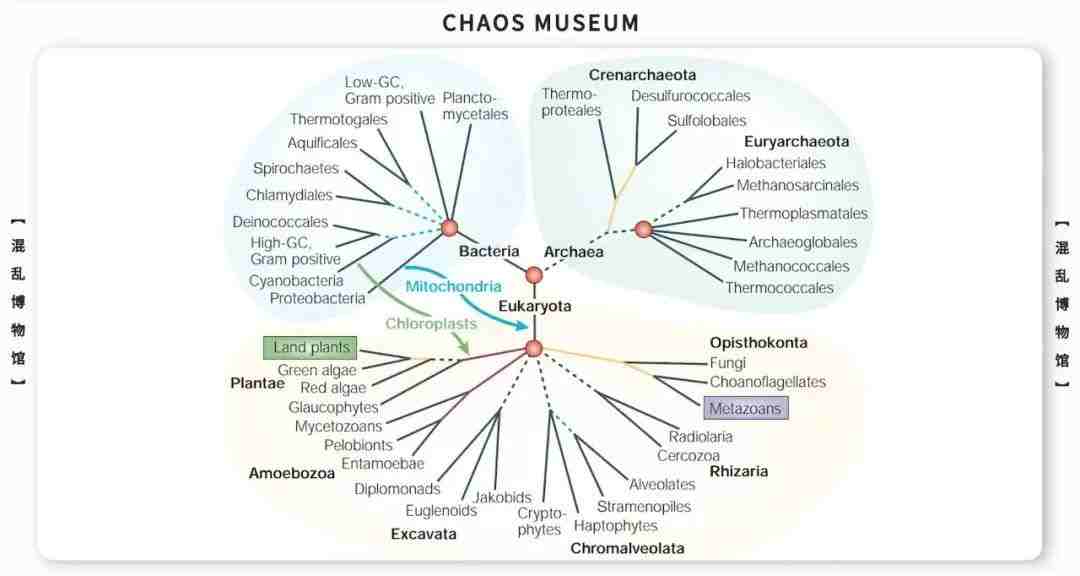


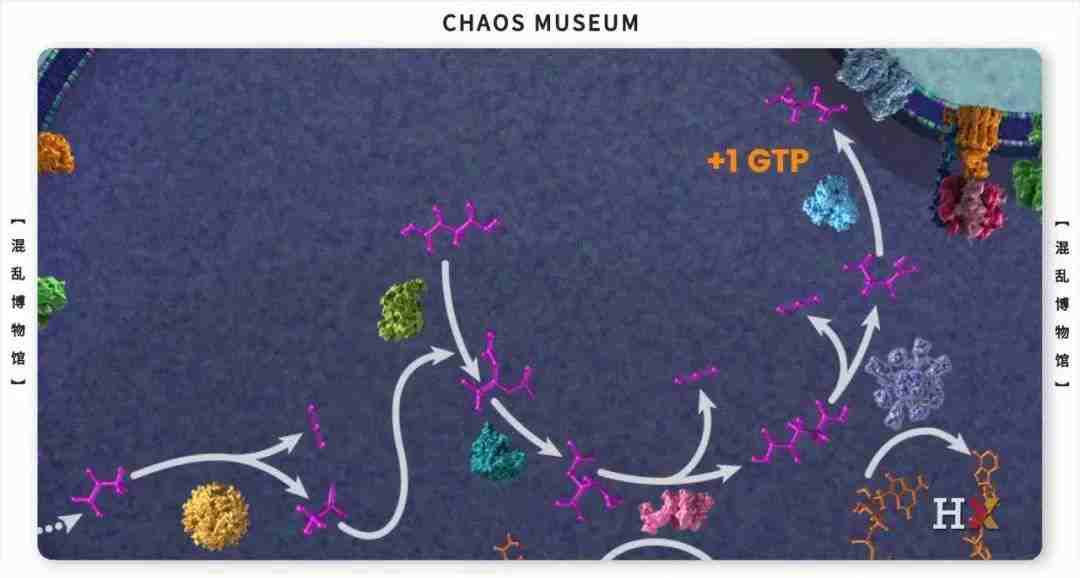









参考文献:
1.Alberts, B., et al. "Molecular Biology of the Cell, 6th edn, 2015." Search PubMed: 1-1342.
2.Bullerwell, Charles E., and Michael W. Gray. "Evolution of the mitochondrial genome: protist connections to animals, fungi and plants." Current opinion in microbiology 7.5 (2004): 528-534.
3.Delsuc, Frédéric, Henner Brinkmann, and Hervé Philippe. "Phylogenomics and the reconstruction of the tree of life." Nature Reviews Genetics 6.5 (2005): 361-375.
4.Ernster, Lars, and Gottfried Schatz. "Mitochondria: a historical review." The Journal of cell biology 91.3 (1981): 227s-255s.
5.Lang, B. Franz, et al. "An ancestral mitochondrial DNA resembling a eubacterial genome in miniature." Nature 387.6632 (1997): 493-497.
6.Sagan, Lynn. "On the origin of mitosing cells." Journal of theoretical biology 14.3 (1967): 225-IN6.
7.Wilson, Edmund Beecher. The cell in development and inheritance. Macmillan, 1900.
混乱博物馆视频号开通啦!欢迎大家踊跃转发、点赞、评论!
▼点击阅读原文,观看混乱博物馆更多视频
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。