《2016奥咨达医疗器械行业蓝皮书》连载-Day3







第3部分 中国医疗器械法规、行政收费及审批结果
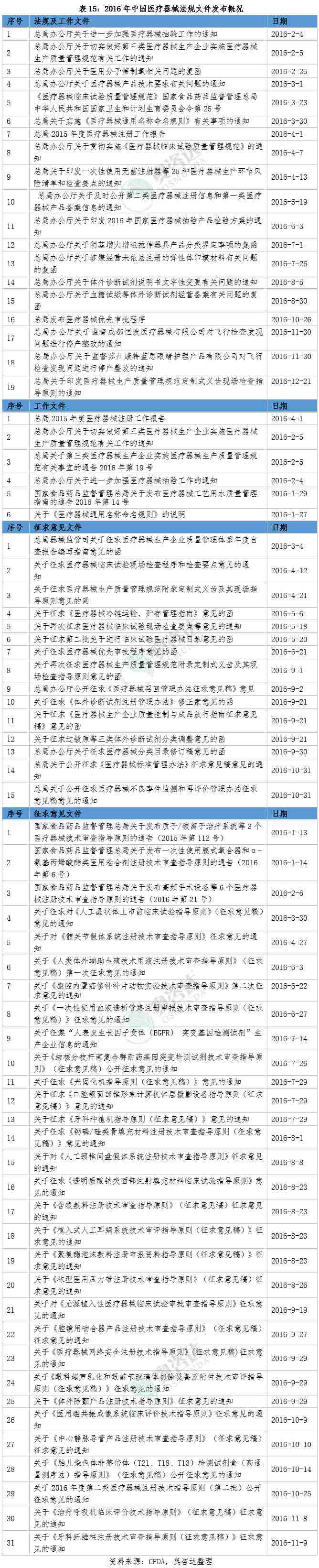
3.1 2016年中国医疗器械法规发布概况
2016年,是中国医疗器械行业法规逐步走向完善的一年。在这一年,《医疗器械临床试验质量管理规范》颁布,为医疗器械临床试验的开展提供了更完善的法规保障。与此同时,多项工作文件、重要文件、指导原则以及征求意见文件的出台,使得整个行业的规范和监管提升了一个台阶,也为整个医疗器械行业的健康发展奠定了坚实的基础。作为国内领先的医疗器械临床试验CRO和医疗器械综合服务提供商,奥咨达可以为医疗器械企业提供一站式的整体法规解决方案,以下为您独家整理2016年中国医疗器械法规的发布概况。
3.2 2016年医疗器械注册收费概况
医疗器械产品注册旨在通过监管部门的市场准入审批,获得合法的上市通行证。各国对医疗器械的注册收费的标准不一,奥咨达作为高端医疗器械临床注册专家,特为您汇总了全球医疗器械注册收费的详情,为您的医疗器械投资提供参考。
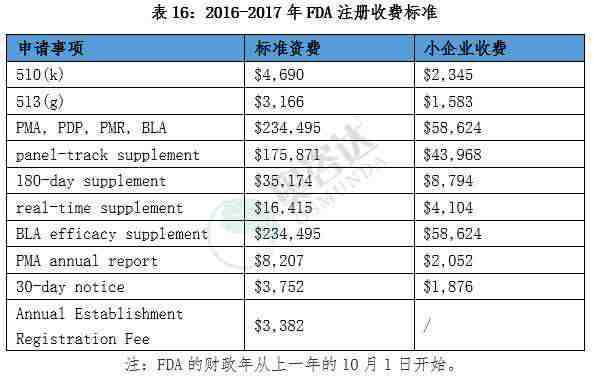
3.2.1 美国FDA医疗器械注册收费标准
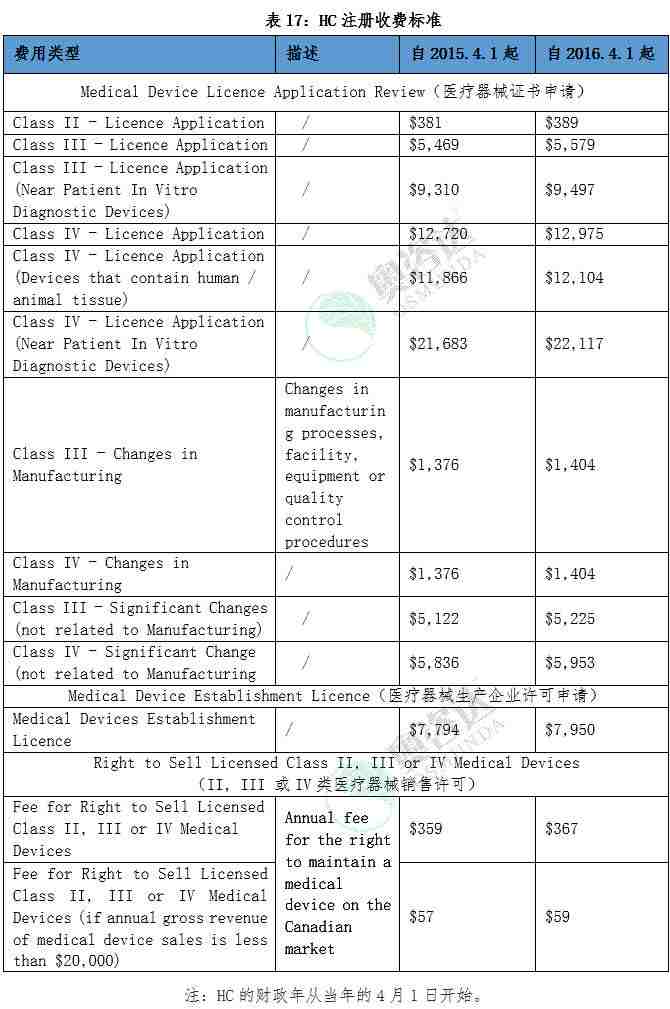
3.2.2. 加拿大HC医疗器械注册收费标准
3.2.3 欧盟CE医疗器械注册收费标准
CE医疗器械注册没用统一的收费标准。申报资料审评费由公告机构收取,不同公告机构的收费标准不同。
3.2.4 中国医疗器械注册行政收费概况
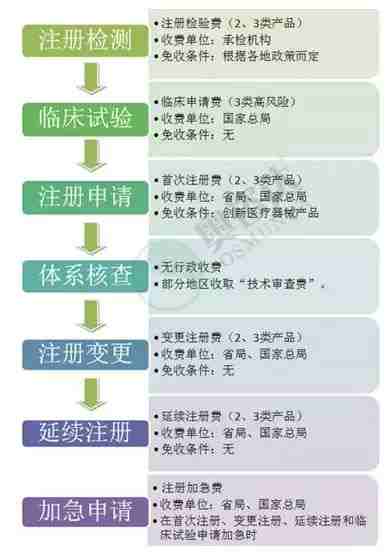
自2015年4月21日,财政部与国家发改委重新规定了食品药品监督管理部门行政事业性收费项目。其中明确了医疗器械产品注册相关的项目费用,包括:首次注册费、变更及延续注册费,临床试验申请费,注册检验费,注册加急费等。
医疗器械在中国注册,行政收费的标准详细情况如下:

奥咨达对此次收费新政做了独家解读:
小结
根据国家局和省局发布的数据可以证明,国家对医疗器械的整个行业的发展越来越重视。国家局通过对医疗器械的注册收费管理,对批准的产品给予特定的标志(注册号)并建立技术档案,可以形成上市后的市场监督的依据,也为注册申请人后期的销售、使用提供了保障。与此同时,医疗器械注册收费标准的出台,不仅可以加强了医疗器械产品注册收费管理,规范注册收费行为,而且保障了注册申请人的合法权益,促进注册工作健康发展,最终使整个医疗器械行业更加规范、健康化发展。
3.3 2016年医疗器械注册审批产品概况
根据CFDA官网上公告统计,国家食品药品监督管理总局共批准医疗器械注册产品13883个,其中境内产品注册2400个,进口产品注册4558个,变更注册6925个。以下是奥咨达为您独家统计的,2016年国家食品药品监督管理总局注册审批的产品概况。
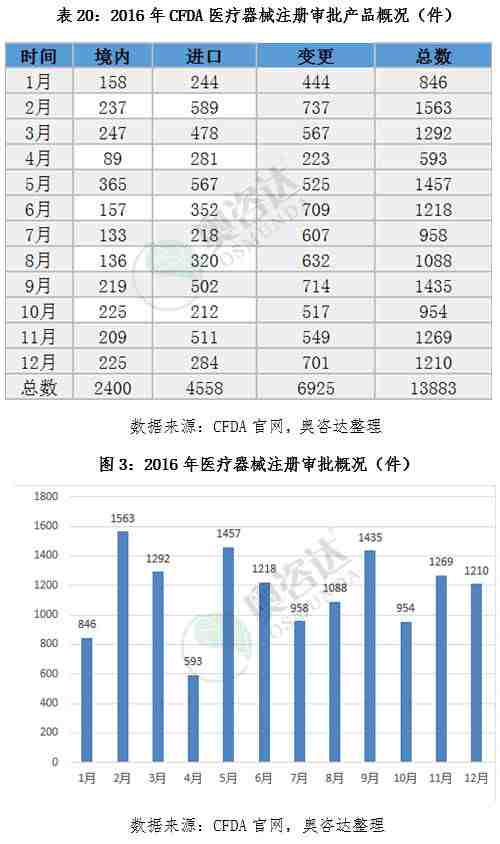
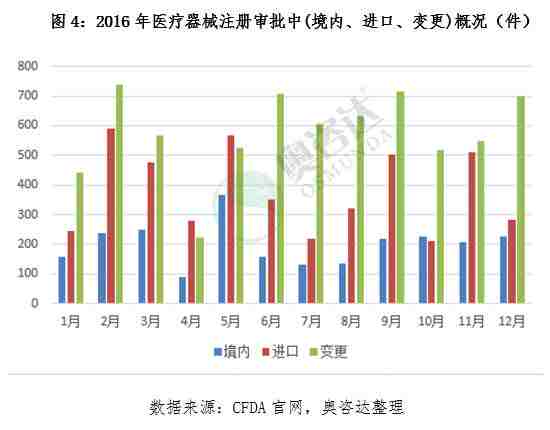
总体来说,我国医疗器械注册管理法规体系初步形成,医疗器械审评审批机制改革有序推进,创新医疗器械审批成果显现。总局批准注册医疗器械产品种类的数量正在稳步增长,这也说明了医疗器械行业正在不断的蓬勃发展。
3.4 2016年中国医疗器械退审产品概况
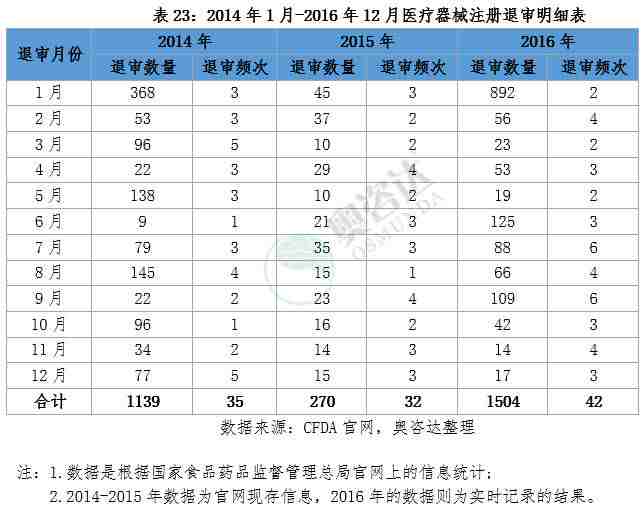
截止2016年12月,食品药品监督管理总局发布的不予注册的医疗器械一共1504项,其中1月份,6月份以及9月份退审数量较多。从细分产品来看,退审的产品包括手术器械、牙科、骨科、IVD试剂、植入器械及人工器官等,从产品的归属地来看,进口器械退审1086项,境内器械退审418项,进口产品是退审的重灾区。关注与了解医疗器械行业最新退审资讯,奥咨达为您梳理了2016年的医疗器械退审数据,详情见以下列表。
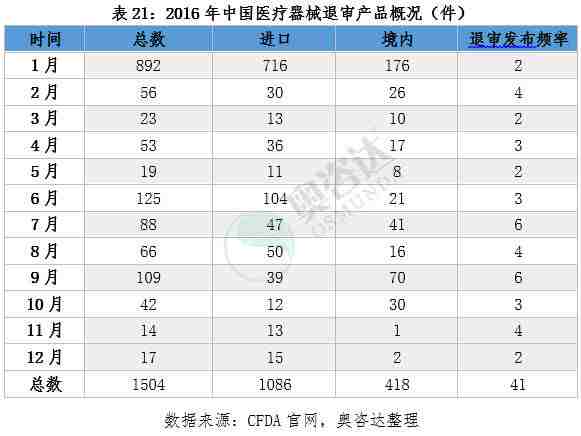
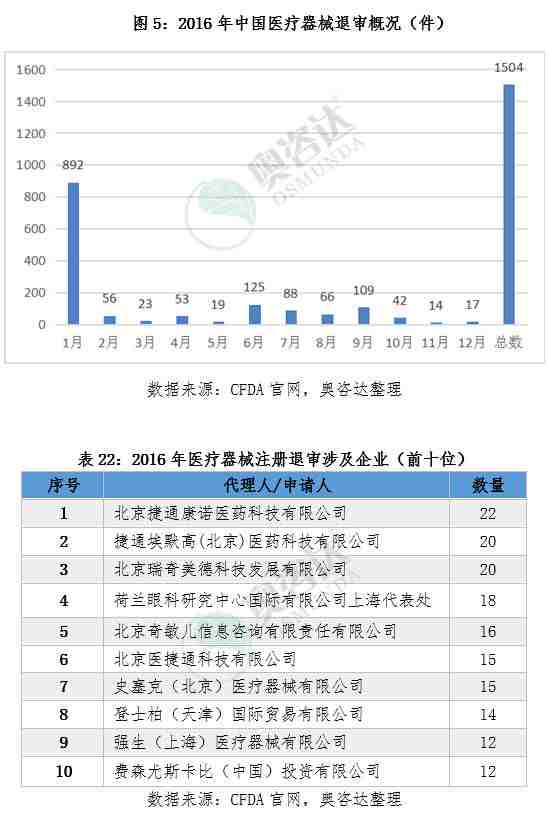
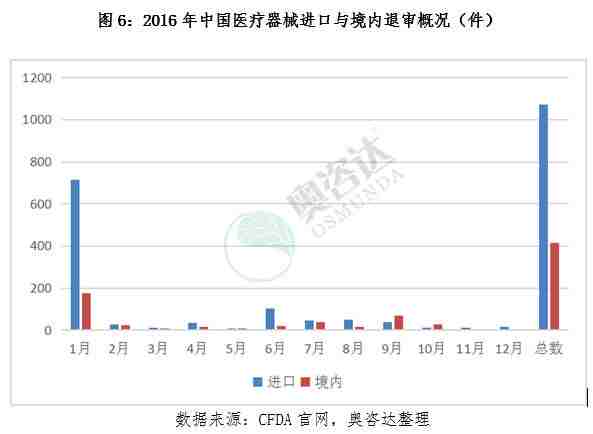
附2014年到2016年退审情况汇总

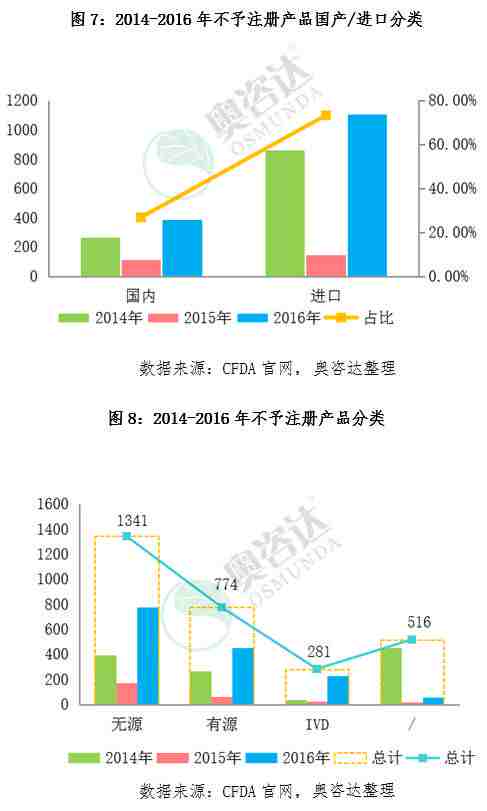
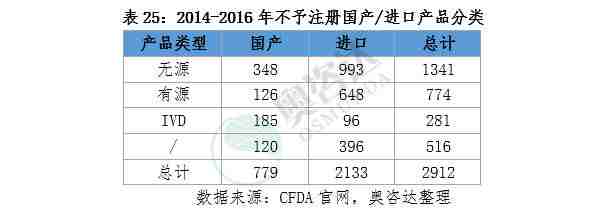
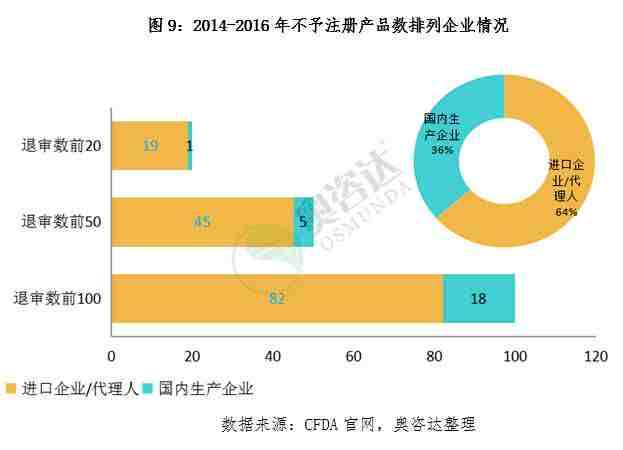
总结:
1.迄今三年来,CFDA共发布了109次退审公告,退审产品数量达2912个。
2.退审的进口注册产品是国产的2.74倍,政府扶持高端国产器械趋势明显。
3.因临床核查真实性存在问题而不予注册或自行撤审的数量在增加,预示是临床试验高标准已经到来。
4.IVD产品退审率飙升,表明IVD产业发展向好,同时也向业界显示了严格要求、规范审评的监管决心。
5.2016年的评审效率明显提升了,清理了多年积压的项目,2016年的退审数量超过前两年总和的6.3%。
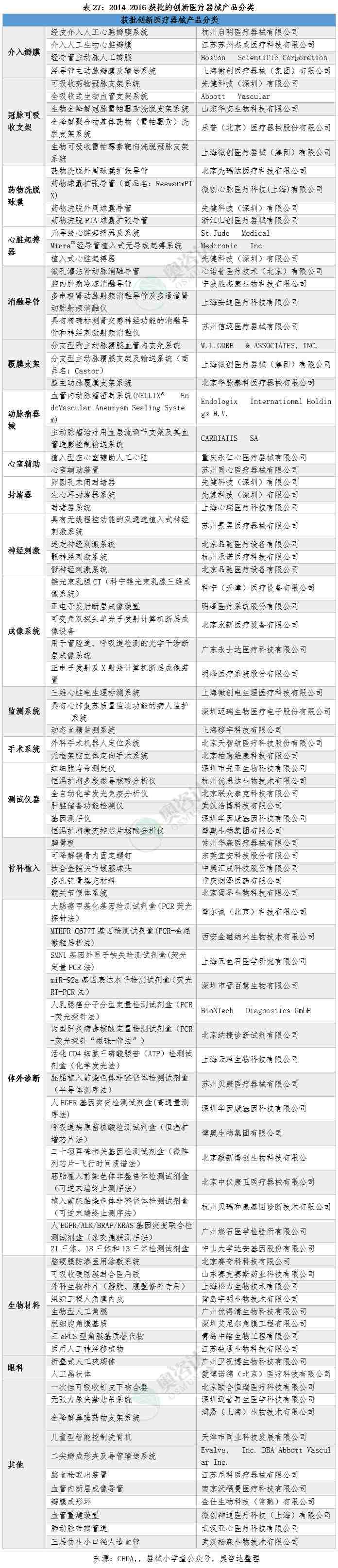
3.5 2016年创新医疗器械审批公示汇总
自2014年2月,国家食品药品监督管理总局发布《创新医疗器械特别审批程序(试行)》以来,创新医疗器械特别审批已进入第三年。该程序是国家总局为促进医疗器械创新发展而推出的重要举措,对鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展起到积极作用。2016年共有45个产品进入特别审批,奥咨达为您独家整理汇总如下:

截止2016年,共有91个产品通过了CFDA的创新医疗器械特别审批程序,按产品类型进行简单分类如下(仅供参考)。其中,血管心脏类产品是创新医疗器械的重点区域。
《2016奥咨达医疗器械行业蓝皮书》明日精彩预告:“第4部分 介绍资本界在医疗器械领域的动态及投融资热点”
敬请期待!


最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。