膀胱癌/尿路上皮癌之HER2靶向治疗
膀胱癌是泌尿系统最常见的恶性肿瘤之一。在全球范围内,膀胱癌发病率位居恶性肿瘤的第9位。
膀胱癌中最常见的类型是尿路上皮癌,占90%。
在HER2高表达的癌症类型中,尿路上皮癌(UC)紧随乳腺癌和胃癌之后,位列第三。因此,HER2靶向治疗自然不能忽视这个可以大展身手的适应症。
在一项临床研究中,对185名中国山东省高级别UC进行了HER2
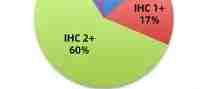
IHC 表达检测, 其中26名(14%)IHC 结果为0, 32 名 (17.3%) 结果为 1+ ,110 名 (59.5%) 为2+ , 17 名为3+
(7.6%)。[1]
所以,关键的问题是:HER2蛋白的表达量到底要有多高,患者才能从靶向治疗获益?
RC48-ADC (维迪西妥单抗, 荣昌生物) 以肿瘤细胞表面的HER2蛋白为靶点,能精准识别癌细胞,并经内吞作用进入肿瘤细胞内部,利用所挂载的化疗药物杀死癌细胞。
RC48-ADC是荣昌生物研发的HER2 ADC药物,最早于2021年获批的适应症是局部晚期或转移性胃癌,适用者为至少接受过2种系统化疗的HER2过表达患者,免疫组化结果为2+或3+。
2022年1月,RC48-ADC在中国获批尿路上皮癌适应症,适用者为接受过含铂化疗且HER2高表达(免疫组化检查结果为2+或3+)的局部晚期或转移性尿路上皮癌患者。
RC48-ADC在HER2阳性局部晚期或转移性尿路上皮癌患者中的进行的2期临床试验,是开放标签、多中心、单臂、非随机化临床研究,入组标准为经组织学证实为UC、HER2阳性、ECOG
PS评分0-1、接受过至少1次既往全身治疗。[2]
共入组了43例患者参加临床试验,中位年龄64岁,患者接受了RC48-ADC单药治疗,主要终点为客观缓解率(ORR),为60.5%。疾病控制率为90.7%。在HER2基因扩增(FISH+)或表达量最高(IHC3+)的亚群中,客观缓解率更高,达70.6%
(12/17) 。
常见的与治疗相关的不良事件包括白细胞减少(51.2%)、感觉减退(41.9%)、脱发(41.9%)、中性粒细胞减少(37.2%)、疲劳(34.9%)、丙氨酸氨基转移酶(ALT)升高(32.6%)以及天冬氨酸氨基转移酶(AST)升高(32.6%)。其中大多数不良事件为1级或2级。[2]
对于HER2低表达或者不表达的UC,HER2
ADC 能达到怎样的效果呢?这就要看一个2期临床试验(NCT04073602)的结果了。
这是一项开放标签、单中心、单臂的研究,
纳入的尿路上皮癌患者至少接受过一种系统治疗,且HER2 IHC结果为 0或1+,ECOG体能状态评分为0或1。患者每两周接受一次RC48-ADC(2mg/kg)治疗。[3]
截至2022年2月,共有19名患者入组,6名患者为IHC
0,13名患者为IHC 1+。对于所有19名患者中,RC48-ADC治疗的客观缓解率为26.3%。细分一下,所有的客观缓解均来自HER2
IHC 1+患者(ORR 38%, 5/13)。所有6名IHC 0患者都没有出现缓解,但均显示疾病稳定。
DS-8201,中文名德曲妥珠单抗(优赫得®),是目前临床上最能打的HER2 ADC。
2024年4月5日,美国食品药品监督管理局(FDA)宣布加速批准DS-8201优赫得®用于治疗不可切除或转移性HER2阳性的实体瘤患者。这是首款全癌种批准的HER2靶向治疗药物。
既然是全癌种实体瘤,那就包括膀胱癌。
FDA的紧急批准,是基于DESTINY-PanTumor02、DESTINY-Lung01和DESTINY-CRC02这三项二期试验中HER2阳性IHC 3+肿瘤患者亚组的结果。因此,对于免疫组化结果为2+的UC患者,目前还没有被DS-8201所批准的适应症所覆盖。
在DESTINY-PanTumor02 临床研究中,DS-8201 在IHC 3+膀胱癌患者中的ORR为56.3%[4]
在美国,已经有5款PD-1抑制剂被批准用于膀胱癌的治疗,使用单一的免疫检查点抑制剂的免疫疗法是标准的、指南推荐的二线治疗方案。HER-2
ADC 与PD-1抑制剂的联用,是目前正在临床试验中的探索。
在转移性尿路上皮癌(mUC)患者的治疗中,RC48-ADC联合托瑞普利单抗(toripalimab)显示出良好的疗效,临床研究的结果报道于2022年美国临床肿瘤学会(ASCO)年会。
关2022年美国临床肿瘤学会(ASCO)年会上的一篇海报讨论会议的摘要。这篇文章讨论了一种新型人源化抗HER2抗体药物偶联物(ADC)RC48-ADC与针对PD-1的人源化IgG4单克隆抗体托瑞普利单抗(toripalimab)联合治疗局部晚期或转移性尿路上皮癌(UC)患者的初步研究结果。
这是一项开放标签、多中心、1b/II期试验(NCT04264936),入组患者接受RC48-ADC治疗,剂量为
1.5或2 mg/kg,每两周联合使用3mg/kg托瑞普利单抗。
- 研究结果:
- 安全性:未观察到剂量限制性毒性,推荐剂量为RC48-ADC 2mg/kg + 托瑞普利单抗3mg/kg,每两周一次。
- 疗效:在中位随访8.0个月时,36名患者至少进行了一次肿瘤评估,最佳客观缓解率(ORR)为83.3%,确认的ORR为76.7%(95%CI: 57.7, 90.1),包括10%的完全缓解(CR)。
- HER2和PD-L1状态:根据HER2和PD-L1状态,确认的客观缓解率有所不同。HER2 IHC(2+或3+)和PD-L1(+)的患者cORR为100%;HER2(2+或3+)和PD-L1(-)的患者为92.3%;HER2(0或1+)和PD-L1(+)的患者为50%;HER2(0或1+)和PD-L1(-)的患者为50%。
- 疾病控制率(DCR):为96.7%(95%CI: 82.8, 99.9)。
- 不良事件:最常见的治疗相关不良事件包括ALT/AST升高(65.9%)、周围感觉神经病变(58.5%)、食欲减退(56.1%)、乏力(56.1%)、高甘油三酯血症(48.8%)。3级及以上的治疗相关不良事件(TRAEs)包括γ-谷氨酰转移酶升高(12.2%)、ALT/AST升高(7.3%)、乏力(7.3%)、高甘油三酯血症(4.9%)和中性粒细胞减少症(4.9%)。9名患者(22.0%,7.3% ≥ G3)出现了免疫相关不良事件(irAEs),包括免疫相关性肺炎、肝炎和肌炎。
这项研究的结论表明,RC48-ADC与抗PD-1抗体托瑞普利单抗的联合治疗在转移性UC患者中显示出有希望的疗效和可控的安全性。
这些数据为正在进行的随机对照试验提供了基础,以确认RC48-ADC和托瑞普利单抗的联合治疗是否可以取代一线化疗方案[5]。
在另外一个临床试验中,16名经一线治疗失败的局部晚期/转移性尿路上皮癌患者接受了RC48-ADC联合PD-1抑制剂替雷利珠单抗(tislelizumab)的治疗,剂量分别240mg/2周(RC48-ADC)和240mg/3周(替雷利珠单抗),结果类似:
随访的中位时间为14个月,期间一个患者为完全缓解(CR),9个患者为部分缓解,ORR
为62.5%。联合治疗的疗效与HER2表达量正相关,在10例 IHC 2+的患者中, ORR为70%;在6例 HER2 IHC 为1+的患者中, ORR为50%。
总结一下:对于转移性UC,HER2
ADC靶向治疗已经成为一种标准治疗方案,治疗效果与HER2过表达量成正相关。HER2 ADC与PD-1抑制剂的联用,可提高HER2靶向治疗的疗效,待临床试验验证之后,预计将成为未来的标准治疗方案,且有可能取代化疗,成为转移性UC的一线治疗方案。
参考文献:
1. Zhu, K., et al., Expression of HER2 in high-grade urothelial carcinoma based on Chinese
expert consensus and the clinical effects of disitamab vedotin-tislelizumab
combination therapy in the treatment of advanced patients. Front Pharmacol,
2024. 15: p. 1355081.
2. Sheng,
X., et al., A phase II study of RC48-ADC
in HER2-positive patients with locally advanced or metastatic urothelial
carcinoma. Journal of Clinical Oncology, 2019.
3. Xu,
H., et al., A phase II study of RC48-ADC
in HER2-negative patients with locally advanced or metastatic urothelial
carcinoma. Journal of Clinical Oncology, 2019. 37: p. 4509-4509.
4. Meric-Bernstam,
F., et al., Efficacy and Safety of
Trastuzumab Deruxtecan in Patients With HER2-Expressing Solid Tumors: Primary
Results From the DESTINY-PanTumor02 Phase II Trial. J Clin Oncol, 2024. 42(1): p. 47-58.
5. Sheng,
X., et al., Preliminary results of a
phase Ib/II combination study of RC48-ADC, a novel humanized anti-HER2
antibody-drug conjugate (ADC) with toripalimab, a humanized IgG4 mAb against
programmed death-1 (PD-1) in patients with locally advanced or metastatic
urothelial carcinoma. Journal of Clinical Oncology, 2022. 40: p. 4518-4518.
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。