国家药监局:美敦力、西门子等企业这些医疗器械必须接受临床抽检(附名单)

点击上方蓝字
关注奥咨达公众号
根据国家药监局最新消息,美敦力、西门子等10家医疗器械企业的这些医疗器械产品必须接受临床试验监督抽查!
6月25月,国家药监局发布《国家药品监督管理局关于发布2018年第一批医疗器械临床试验监督抽查项目的通告》,公布2018年第一批医疗器械临床试验监督抽查项目名单。
根据2018年重点工作安排,国家药监局抽取胶囊内窥镜系统(受理号:CQZ1700095)等10个注册申请项目,对其临床试验数据真实性、合规性组织开展现场监督检查。
具体检查时间安排和抽查的临床试验机构由国家药监管局食品药品审核查验中心另行通知。
通告还强调,自本通告发布后,不再受理注册申请人对上述项目的自行撤回申请。
对于临床试验有问题的产品,自行撤回申请是一种战术上的后撤,是一种明智的止损行为。撤回后,可以重新再做临床试验,这样或许还有机会通过审核。
而不准撤回申请,意味着这一条后路被切断。产品就算临床试验真有问题,也只能硬着头皮上了。
而一旦被查出临床试验存在问题,不仅产品不能再次申请注册,企业前期的投入也就打水漂了。这对于任何医疗器械企业来说,都是不愿看到的结果。
尽管这样,临床试验被查出问题的产品还是比比皆是。对此,药监部门也加强了对医疗器械的临床抽检,同时还出台相关文件,促使临床抽检更加规范和常态化。
此次需要接受临床抽检的10个项目共涉及10家医疗器械企业,其中,大名鼎鼎的美敦力、西门子也分别有1个产品在列。
2018年第一批医疗器械临床试验监督抽查项目名单

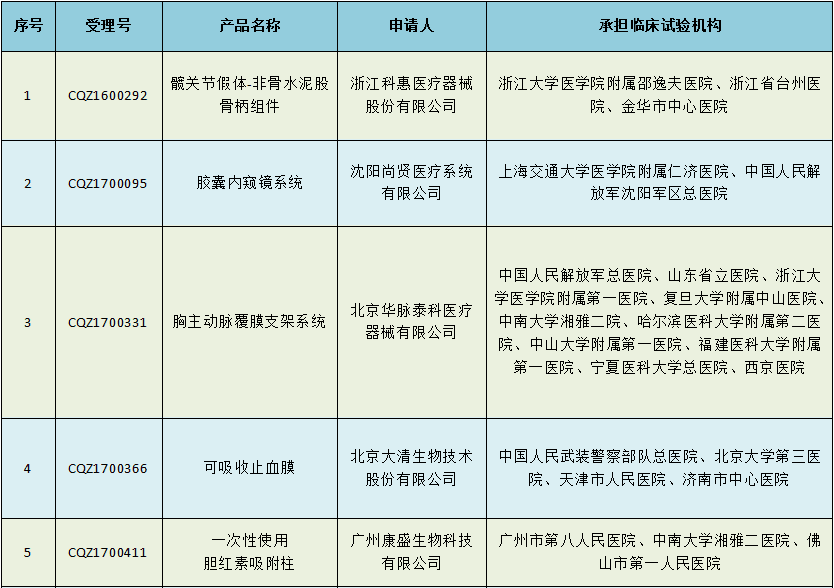
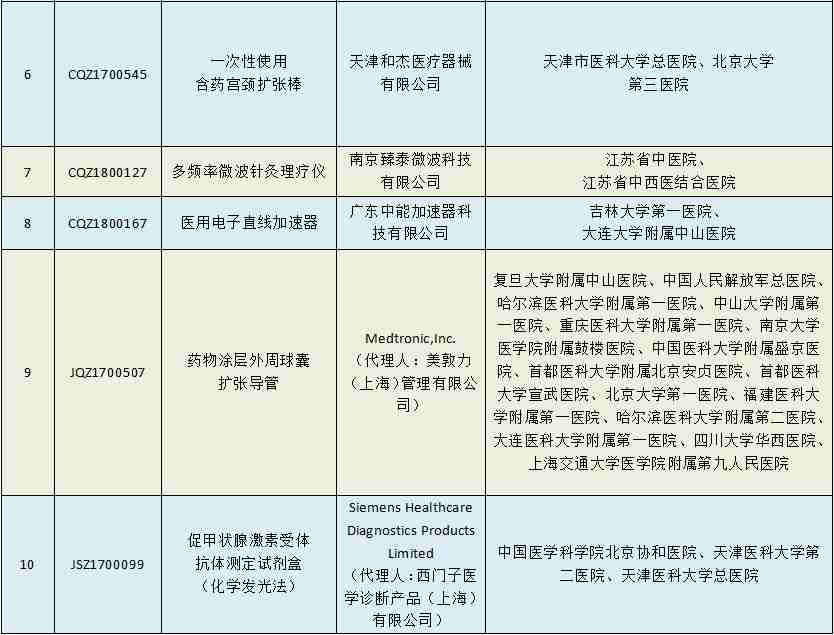
此次抽检主要是对以上10个产品的临床试验数据的真实性和合规性进行监督检查。
按照国家药监局6月1日最新发布的《医疗器械临床试验检查要点及判定原则(征求意见稿)》,根据检查发现的问题,检查结果按以下原则判定:
一、有以下情形之一的,判定为存在真实性问题:
1.编造受试者信息、主要试验过程记录、研究数据、检测数据等临床试验数据,影响医疗器械安全性、有效性评价结果的;
2.临床试验数据,如入选排除标准、主要疗效指标、重要的安全性指标等不能溯源的;
3.试验用医疗器械或体外诊断试剂不真实的。如以对照用医疗器械替代试验用医疗器械、以试验用医疗器械替代对照用医疗器械,以及以其他方式使用虚假试验用医疗器械;
4.瞒报严重不良事件和可能导致严重不良事件的医疗器械缺陷、方案禁用的合并用药或医疗器械等;
5.注册申请的临床试验报告中涉及安全性和有效性数据与临床试验机构保存的临床试验报告中的数据不一致的;
6.注册申请的临床试验统计分析报告中涉及安全性和有效性数据与数据库数据或分中心小结中数据不一致的;
7.临床试验方案中未明确规定临床试验用样本可以重复使用,而临床试验过程中重复使用临床试验用样本的;
8.其他故意破坏医疗器械临床试验数据真实性的情形。
二、未发现真实性问题的,但临床试验过程不符合医疗器械临床试验相关规定要求的,判定为存在合规性问题。
三、未发现上述问题的,判定为符合要求。
虽然关于医疗器械临床试验检查要点及判定原则的文件目前还在公示阶段,但是很有可能,此次的临床抽检将遵照此文件执行。
而如果是这样,以上8种情形将成为判定产品是否存在真实性问题的最直接的证据。因此,各械企可要小心应对了。
这10个产品的临床试验监督检查结果到底如何?是否真实和合规呢?我们拭目以待!
【来源】中国医疗器械采购公共服务平台
【全文整理】奥咨达
【声明】部分文章和信息来源于互联网,不代表本订阅号赞同其观点和对其真实性负责。如转载内容涉及版权等问题,请立即与我们联系,我们将迅速采取适当措施。

热点推荐
可点击标题阅读原文
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。