看一家罗氏19亿收购的企业如何将真实世界证据用于肿瘤治疗
如今,基因测序和计算蛋白质组学技术发现了越来越多的罕见肿瘤基因变体,遗传学信息在精准医疗中发挥着越来越重要的作用。基于体细胞突变、蛋白质组特征和细胞信号通路的真实世界数据分析,可能是目前探索分析这些罕见基因变体如何致病的最经济实用的方法。[1]
随着医学界对肿瘤治疗的理解加深,以及精准医疗和AI大数据技术的飞速发展,针对肿瘤遗传学信息的真实世界证据研究迎来了一些可喜的突破。本文将以Flatiron这家最近炙手可热的企业作为案例,分析真实世界证据的研究进展及局限,遗传信息数据库的建立及其对肿瘤治疗的指导作用,讨论真实世界证据在抗肿瘤精准医疗中的应用现状、难点及前景。
文/吴颖仪
编/HLR
1
真实世界证据已有哪些应用?
自2016年美国国会发布《21世纪治愈法案》(21st Century Cure Act),“真实世界证据”(Real World Evidences,以下简称RWE)开始成为医疗界的高频词汇。
RWE 定义
国际药物经济学和结果研究协会(ISPOR)将RWE宽泛定义为除传统临床试验以外获得的证据。20世纪50年代,美国一些实用性临床试验已开始采用干预性真实世界研究方法,最早提出“真实世界证据(Real WorldEvidences, RWE)”的概念,即通过在特定研究背景下对真实世界数据(Real-World Data,RWD)的进一步汇总分析,获得能够证明医药产品安全性或有效性的证据。[2]

▲ 图为RWE常见生成过程
《21世纪治愈法案》从法律层面允许制药企业在新药或老药新适应症的申请中,提供观察研究、保险支付、患者信息、适应性临床试验设计和其他零星数据(anecdotaldata)等“真实世界数据”,以及提炼生成的药物有效性及安全性“证据”,而无需进行传统随机控制试验(randomized controlled trial,RCT)。[3]
法案出台后,制药巨头及风险投资机构开始不惜投入重金启动RWE项目,合同外包服务机构(contract research organization,CRO) 加速联合数据分析技术公司,而专注RWE分析的初创企业获得大笔融资也不再是一件难事。
然而,目前较成熟的RWE研究至今仍只应用于在药物上市后安全性及有效性评价,或较低成本替代性药物的疗效评估等,通常涉及的适应症包括高血压、心脏病、糖尿病、哮喘等欧美国家高的发疾病及各类肿瘤。
2012年,葛兰素史克(GSK)开展全球首例药物获批前的RWE研究项目——哮喘与慢性阻塞性肺病(Chronicobstructive pulmonary disease,COPD)药物Relvar(该药2013年在欧洲和美国获批)在英国曼彻斯特Salford市日常医疗中的应用。研究发现Relvar可降低COPD中度或重度恶化率8.4%。此外,与其他已上市药物相比,每日仅需服用一次的Relvar提高了患者的用药依从性,使药效得以充分发挥,也有助于降低恶化率。这是严格执行药物治疗方案的传统RCT试验中无法得到的结果。然而,尽管这是一个有趣的尝试,但对医生处方决策却没有显著的帮助。[4]
2
Flatiron:
如何搭建一个综合临床基因组数据库?
据调查,在美国超过1300万的癌症患者中,只有约4%的患者参与到临床试验当中,其他96%患者的电子健康记录(Electronic Health Record, EHR)信息尚未得到充分利用。在新药临床试验方面,肿瘤药物的RCT临床试验经济和时间成本比起病种更高,若合理引入RWE研究结果,如利用RWE筛选受试患者,可显著提高效率。
在临床诊疗方面,把真实世界数据中治疗结果与遗传学信息关联起来,如在治疗结果与体细胞突变、蛋白质组特征和细胞信号通路致癌可能性之间建立联系,对于疾病的预后和外部控制基准的制定是很有意义的。当然,还需要不断提升数据容量和分析技术,尤其对于一些与多个基因突变相关的罕见、复杂病症。[5]
在AI大数据盛行的今天,处于全球科技创新前沿的美国不缺医疗数据分析的公司,而针对肿瘤医疗真实世界数据研究的公司却相对较少。近年倍受制药巨头追捧的一只“独角兽”,来自美国纽约的Flatiron Health在这方面做了一些突破性的尝试,美国FDA也已向其抛出橄榄枝。

Flatiron的创立,始于创始人Nat和Zach的调研,他们发现美国乃至全球范围内多数国家医疗保健系统数据信息高度分散。这促使他们萌发创立一个肿瘤医疗真实世界数据整合分析平台的想法,Flatiron因而在2012年诞生。

▲ 图为Flatiron Health创始人Nat和Zach
来源于Flatiron官网
作为一个专攻肿瘤医疗的RWE分析平台,Flatiron已与美国800多家肿瘤诊疗机构、2500多名临床医生建立长期合作。除了使用自建的肿瘤患者电子健康记录数据库,Flatiron还引入Foundation Medicine、Epic等其它数据库信息,初步建立了社区肿瘤学云数据存储和分析平台“OncoCloud”,不仅可以从EHR和保险理赔记录中抓取结构化信息,还能对学术文献,医生诊疗笔记等“非结构性”数据进行整合。
经过近6年的发展,Flatiron已在肿瘤诊疗真实世界数据分析技术领域取得诸多引人瞩目的成果。近日,Flatiron向美国临床肿瘤协会(American Society of Clinical Oncology,ASCO)成功提交11项摘要,主要针对非小细胞肺癌、乳腺癌、肾衰竭等病种,开展患者年龄、身体质量指数(Body Mass Index,BMI)、基因档案等指标与非小细胞肺癌、乳腺癌等癌症发生的相关性研究,以及肿瘤免疫治疗数据研究,药物使用对比研究等。[8]
今年2月,Flatiron被罗氏(Roche)以19亿美元收购,这在业内被视为罗氏肿瘤个性化医疗战略的重要一步。[7]
6月初,Flatiron在ASCO 2018年会上展示了其与FoundationMedicine合作搭建的“临床基因组数据库”(Clinico-GenomicDatabase,CGDB),并汇报了相关研究成果。
3
CGDB:
如何展开基于RWE的个性化肿瘤治疗?
FDA“肿瘤卓越研究中心”(OncologyCenter of Excellence, OCE)副总监Sean Khozin长期关注RWE在肿瘤治疗领域的应用,也参与了Flatiron肿瘤临床基因组数据库(CGDB)对精准医疗支持作用的研究。今年5月,HealthAffair期刊刊登了其作为第二作者的相关论文。[9]

▲ 来源:Health Affair
该研究通过CGDB数据库展开。CGDB现存有3500多名肺癌患者,2000名结肠癌患者,2000名乳腺癌患者的信息。除了超过315个基因的遗传异常情形之外,现有的原始测序数据能够辅助计算出肿瘤突变带来的影响,并确定患者与癌症发生有关,可用于癌症检测的微卫星不稳定状态 (microsatelliteinstability,MSI)。
早在1993年,Jacobs等人在结直肠癌中首次发现MSI现象,与癌症发生有关,可用于癌症检测。MSI是指在DNA复制时插入或缺失突变引起的MS序列长度改变的现象,是检测癌症的分子标记,表现为同一微卫星位点在不同个体之间或者同一个体的正常组织与某些异常组织之间重复单位的数目不同,DNA错配修复是造成MSI的主要原因。[10]
追踪“肿瘤治疗旅程”
研究人员回顾了一位晚期非小細胞肺癌(Non-small cell lung cancer,NSCLC)患者的疾病发展过程中被记录下来的信息,包括人口学信息、各项身体指标数据、病史、基因测序结果、对每个遗传异常(包括染色体畸变和基因突变)的注解,以及主治医生基于CGDB数据得出的诊断结果、治疗方案、相关研究文献、FDA档案和基因组数据的大型公共数据库(通常由全国各地的许多诊断实验室采取的方法)的搜查与综合分析,展示了常规病人护理过程中收集的数据如何为大众提供精准医疗服务。
一位名为JD的患者(经过去个人信息识别化处理)的“肿瘤治疗旅程”如下:2011年,JD在当地癌症治疗中心进行生物活检,被诊断为NSCLC,并接受手术切除和及辅助化疗;2015年,JD经过CT扫描、活检诊断为NSCLC复发。
基因测序结果发现,JD体内可能发生突变的基因是KRAS和STK11,存在十几种对人体影响不明确的突变。
医生首先瞄准KRAS基因突变/扩增,将MEK抑制剂 Mekinist(trametinib)列作一种可行疗法;其次针对STK11的变体,参考CGDB系统中的RWE以及Afinitor(everolimus)、Torisel (temsirolimus)等mTOR信号通路抑制剂的疗效总结文献(STK11突变可能激活mTOR通路,促进癌细胞增值或转移),可知这些抑制剂虽尚未参与NSCLC治疗试验,但对STK11突变引起的乳腺癌等肿瘤类型疗效显著。
医生最终选择了trametinib作为一线药物。结果显示,前8个月疗效明显,但16个月后出现肿瘤。医生再根据RWE选出的最稳妥治疗方案,即卡铂联合紫杉醇的标准化疗方案,放弃了RWE认为个体疗效偏差较大的免疫检查点抑制剂疗法。然而,JD在接受化疗2个月后,因并发症发作而死亡。
在JD的治疗案例中,RWE应用的不足之处在于CGDB数据库尚未有与JD的突变基因类型相似的NSCLC患者数据。但JD的“肿瘤治疗旅程”被完整记录在CGDB中,包括主治医生作出诊断和治疗方案决策的依据。随着CGDB数据库中治疗案例不断积累,与机构合作形成数据聚合,RWE将能为医生的诊疗决策给出更科学的提议。
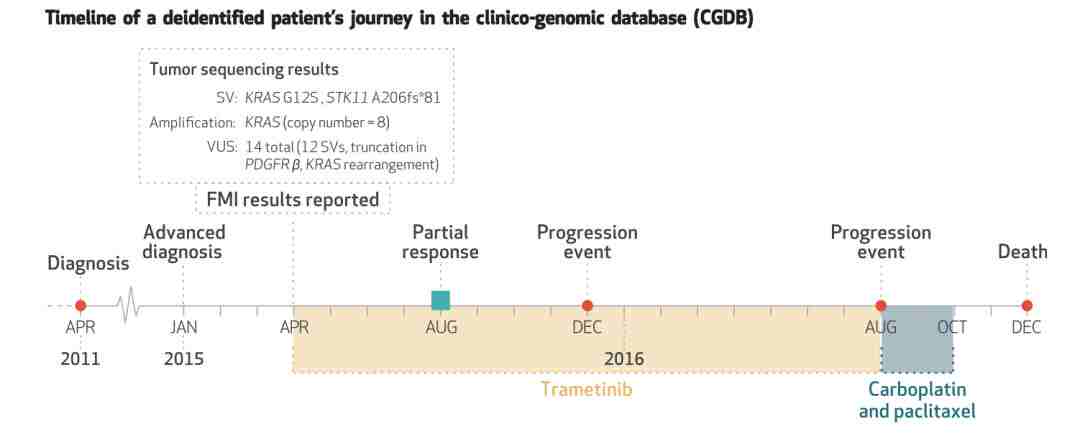
▲ 图为患者JD的NSCLC疾病发展历程
来源于Flatiron 发表的研究成果
4
MSI:肿瘤免疫RWE的一种打开方式
如果说肿瘤免疫疗法是“组织未定性”(Tissue-agnostic)肿瘤患者的福音,那么真实世界数据则能够为这些疗法效果的预估提供重要参考。
首支组织未定性PD-1单抗Keytruda 获批,用于微卫星不稳定性高(MSI-H)的原发部位未知的实体瘤患者。FDA的批准决策基于149名患者参与的随机对照试验,这些患者罹患的实体瘤遍及15种不同器官或组织,且都带有MSI-H。
研究人员通过CGDB可以查询到MSI-H在众多肿瘤类型中的流行率。他们发现,MSI-H在子宫内膜癌中最常见,接近16%,在晚期大肠癌中流行率约为5%,肺癌则为1%,而原发部位未知来源的肿瘤MSI-H流行率接近3%。
MSI-H肿瘤患者在RCT试验中对Keytruda有较高的应答率。在更广泛的肿瘤治疗实践中,还有成千上万每天使用Keytruda等免疫检查点抑制剂的患者诊疗数据未被收录,而部分患者已通过肿瘤分子图谱分析获知MSI水平。 有研究认为,MSI检测目前能够帮助PD-1免疫治疗的获益预测,II期结直肠癌患者用药指导和预后预测,遗传性非息肉病性结直肠癌(HNPCC)筛查等。
Flatiron因此观察了251名MSI-H患者,其中38人(15.1%)接受了免疫检查点抑制剂治疗。随着CGDB样本量的增加,对MSI-H晚期恶性肿瘤患者免疫检查点抑制剂的使用和疗效研究也将更深入。在CGDB中,接受检查点抑制剂治疗的MSI-H患者的比例从2017年5月FDA批准Keytruda前约10.1%的水平增长到2017年9月的15.1%。
当前,Flatiron正继续开展前瞻性临床试验,用于对比MSI-H和其他患者的免疫治疗反应。
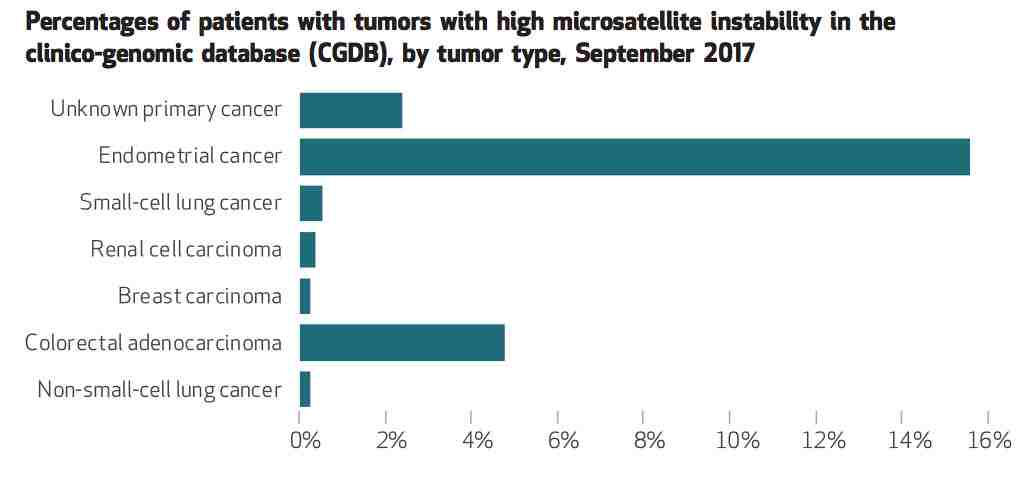
▲ 图为2017年9月CGDB数据库中不同肿瘤类型MSI-H患者占比。来源:Flatiron有关分析
5
未来方向
Flatiron的案例分析,展示了RWE在肿瘤精准医疗实践中的巨大潜能。
如何从浩繁庞杂的真实世界数据中选取与研究目的相契合的数据,开展真实世界研究,提高数据关联度,减少偏倚,是目前RWE研究待解决的关键问题。由于很多数据的收集并非以研究为目的,且各中心数据的纳入标准不同,因此在统一命名的基础上,预先明确采集哪些数据,多次采集之间的时间间隔至关重要。
Flatiron采取的方式是通过综合分析更多的非结构性数据,降低预测偏差,这在目前是较为有效的方式。但RWE所需的原始数据始终还是需要相对统一的标准,这需要更多的诊疗或研究机构努力建立并完善。
整合非结构性数据减少偏倚
在减少数据偏倚方面,Flatiron已做出一些值得推广的尝试。在“基于美国国家死亡指数(National Death Index, NDI)验证OncoCloud平台死亡率数据灵敏度的研究”中,Flatiron引入了医生诊疗笔记等电子健康记录中非结构化信息(abstractedfrom EHR unstructured fields,ABS),公开的社会福利残障保险数据(Social Security Disability Insurance,SSDI)和来自商业机构的死亡数据(commercialdeath data,CDD1)。[6]
研究发现,提高死亡率数据的完整度,能大大减少OncoCloud对患者生存略预测与基于NDI的预测之间的差距。例如,ABS、SSDI、CDD1等数据加入分析后,NSCLC患者死亡率综合数据灵敏度从原有EHR数据库的66%提高到91%,一定程度上解决NDI等国家级数据访问权限缺失的问题。
数据聚合
在前文提及的JD治疗案例中,后续RWE研究其实还有很多问题等待深入挖掘:比如是否KRAS较短的变体帮助了JD对trametinib的反应?KRAS的扩增是否发挥了作用?其它基因组和临床特征对JD的药物治疗有什么影响?其它基因突变类型相似的病人接受不同治疗方案的结果是什么?
这些问题须从更大量的遗传信息相近患者的共享数据中寻找答案。目前来看,最高效的数据聚合方式是机构间共享。
继2016年昆泰(原名Quintiles,合并后名为IQVIA)与IMS Health的里程碑式合并之后,CRO与大数据分析公司结盟一直是一种受欢迎的合作模式。今年5月,CRO组织Worldwide Clinical Trials(WCT)和医疗研究及患者医疗数据供应商Datavant决定将开展真实世界数据的合作,研究神经退行性疾病的临床试验失败原因,探索能够改善研究长期监控和执行的大数据策略。[11]
随着肿瘤患者EHR的数据库不断增长,以及来自肿瘤分子的基因组信息不断丰富,RWE研究准确度也将更精准地指导不同个体的肿瘤治疗,并进而为精准医疗干预提供必要证据。
参考资料:
1.DJ Dickson, JD Pfeifer. (2016)Real-World Data in the Molecular Era—Finding
the Reality in the Real World. ClinicalPharmacology & Therapeutic, Vol.99, No.2.
2.Rachel E. Sherman, Steven A.Anderson,GeraldJ. Dal Pan,etal. (2016). Real-World Evidence - What Is It and What Can It Tell Us? The New England Journal of Medicine. Vol.375; 23.
3. https://www.congress.gov/bill/114th-congress/house-bill/34/text
4.John P New, Nawar D Bakerly,et al (2014). Obtaining real-world evidence: the Salford Lung Study. Thorax. 2014; 0:1–3.
5.Sean Khozin, Gideon M.Blumenthal, Richard Pazdur (2017) .Real-world Data for Clinical EvidenceGeneration in Oncology. JNCI J Natl Cancer Inst, 2017, Vol. 109, No. 11.
6.Melissa D. Curtis, Sandra D.Griffith, et al(2018). Development and Validation of a High-QualityComposite Real-World Mortality Endpoint. Health Services Research. Volume 53, Issue3.
7.https://flatiron.com/oncology/
8.https://flatiron.com/press/press-release/flatiron-health-announces-research-to-be-presented-at-american-society-of-clinical-oncology-2018-annual-meeting/
9.VineetaAgarwala, Sean Khozin, Gaurav Singal, etal. (2018) Real-World Evidence In Support Of Precision Medicine:Clinico-Genomic Cancer Data As A Case Study. Health Affairs. 37, NO.5 (2018): 765–772
10.https://link.springer.com/referenceworkentry/10.1007%2F978-3-642-16483-5_3731
11. https://www.fiercebiotech.com/cro/worldwide-clinical-trials-partners-datavant-for-real-world-data-pilot-study
下周6.20路演因端午节放假暂停一期,我们下期再见 : D


本期作者:吴颖仪
香港浸会大学公共卫生硕士,目前从事国内外药品采购政策与市场分析,曾供职知名医药产经媒体采编,长期关注全球制药与生物技术企业投资并购、新老药物市场策略。现任美柏医健研究员。
文章版权归【美柏医健】所有,欢迎转发,转载请参照“转载须知”。
投稿或应聘,请将简历发送到
精选内容
美柏路演
▼ 点击阅读原文,查看更多好内容
最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。