癌症早期诊断及监测——循环肿瘤DNA检测的应用


肿瘤的早期诊断和治疗是保证肿瘤病人预后的重要因素。肿瘤的早期诊断一直是临床研究的努力方向。目前的早期诊断技术很大程度上依赖于物理方法的检查,比如放射影像学诊断,超声波检查。想做到确诊则不得不有赖于组织的病理学检查。但组织活检已不能归于肿瘤早期,而且一般为有创检查。
随着核酸测序技术的发展,测序的精准度空前提高,测序成本的持续下降,使得循环血中游离DNA的检测成为可能。伴随着相关肿瘤机制研究的深入,生物大数据分析工具的成熟,循环肿瘤DNA检测极有可能成为可以信赖的肿瘤早期诊断,肿瘤治疗监测和肿瘤预后评估的无创检查工具。本文就该领域的最新进展和潜在应用做简要探讨。
文/Stephen 王
编/HLR
1
循环游离核酸的检测
核酸作为遗传信息储存及传递的大分子主要存在于细胞内,处于体液中游离状态的核酸一般含量极低,而且很不稳定。人类发现体液中存在游离核酸的历史可以追溯到70年前,但当时并不明了其存在的意义。后来人们把体液中游离核酸与疾病联系起来,距今也有50年时间了(1)。
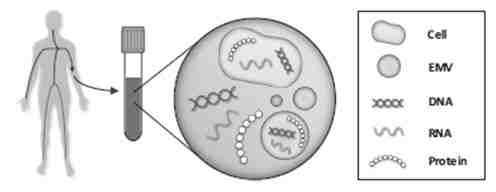
▲ 液体活检示意图
EurJ Hum Genet. 2018 Apr 23
核酸有很多种,基因组DNA,线粒体DNA,mRNA,microRNA,longncRNA等等。而所有这些种类的核酸成分,目前都可以在循环血中检测到(1)。而且有很多研究发现了这些循环血中核酸成分的增加和心血管疾病,代谢疾病以及癌症的相关性。比如循环游离线粒体DNA有可能和心血管病的高风险有相关性(2)。循环游离小RNA和脂质代谢有潜在的相关性(1)。
在所有这些循环游离核酸中,循环游离DNA在癌症的诊断治疗中的作用,研究的最透彻,应用的也最广泛。
2
循环肿瘤标记物的检测
在循环肿瘤DNA(circulating tumor DNA, ctDNA)之前,检测循环肿瘤细胞(Circulating Tumor Cell, CTC)是被广泛接受的循环血肿瘤检测技术。在循环血中做到肿瘤细胞的检测需要两步:肿瘤细胞的富集和肿瘤细胞的探测。
由于血中的细胞种类繁多,从众多的血细胞中富集到足够多的肿瘤细胞以作为检测是一道艰难的屏障(3)。最近新的基于尺寸适应型的富集技术(Size-Based Enrichment)可以提高收取肿瘤细胞的效率(4)。第二步是通过蛋白核酸的检测以确定肿瘤细胞的生物学特性。
CTC技术的优点在于引申步骤:收集到的肿瘤细胞可以用于进一步的体外细胞培养和扩增,可以用于蛋白,DNA和RNA的大分子功能检测,甚至可以用于动物的体内实验。CTC的主要局限在于它的代表意义:在非转移癌的条件下,CTC几乎很难检测,意味着用于肿瘤的早期诊断有先天的不足,加上技术上的瓶颈带来成本居高不下。
但是CTC检测技术发展的时间相对较长,已经在其自身的检测领域发展出了相对成熟和可靠的标准。强生公司的CellSearch 系统是目前FDA唯一批准的用于临床的CTC检测的平台(3)。

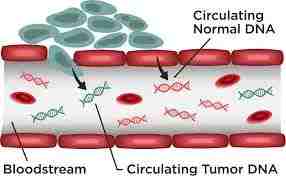
对比于CTC,循环肿瘤DNA的检测则相对年轻。循环肿瘤DNA含量低,不像CTC那样可以检测除DNA以外其它大分子的生物活性,但是提取出来的DNA可以长期保存以供将来研究。
循环血中可提取的游离DNA大概在每毫升30-50纳克(10-6g)左右(1,5)。而在这区区的30纳克DNA中,来源于肿瘤的DNA更是微乎其微。但是在肿瘤发病的早期,肿瘤细胞DNA即可被释放到外周血中。所以即便少,但只要检测得到,就对肿瘤的早期诊断意义重大。得益于新一代DNA测序技术的灵敏性,即便是痕量的DNA也能得到有效的扩增和探测(6)。
DNA含量低只是检测ctDNA的技术难点之一。另一个难题在于如何鉴别一段检测到的DNA是来源于肿瘤细胞还是血中其它的正常细胞。而对DNA序列的诠释,则不得不归功于多年的肿瘤细胞测序和肿瘤机制研究的积累。很多肿瘤DNA都带有特定肿瘤的标志物(某种“密码”)。这种“肿瘤密码”是DNA序列中特定区段的变异。通过比对这些位点的差异,可以判定DNA是否来源于某种肿瘤细胞(6-8)。
当然,肿瘤DNA检测的指标不仅限于已知的变异位点,通过全基因组的扫描测序,会发现很多未曾报道或者尚未有明确意义的DNA变异(6-8)。而如何评估这样的变异,它们是否具有可信的临床意义,这些是目前技术革命带给检测领域的新挑战。除此而外,通过检测DNA的修饰,尤其是甲基化修饰也成为早期检测“肿瘤密码”的一部分(9,11)。
3
循环肿瘤DNA检测的临床应用
尽管大量的研究文章显示,循环肿瘤DNA检测的可操作性越来越强,应用价值巨大,应用前景广阔,但迄今为止,循环肿瘤DNA检测尚未被临床肿瘤治疗广泛接受和认可(10)。主要问题在于检测的灵敏度和特异性参差不齐,突变位点检测的可重复性不强,潜在的新变异无法得到确认,检测出的新靶点无法和肿瘤的发生发展建立有效的关联(6,10)。
目前大部分测序公司都可以检测特定位点的DNA变异。但检测位点的选择却并无统一标准。由纪念斯隆-凯特琳癌症中心开发的MSK-IMPACT, 2017年底成为FDA首次批准的多基因特定位点检测系统(8)。
除了特定变异位点的检测,DNA甲基化修饰的检测在肿瘤中也成功的得到了应用。
中山大学和加州大学圣地亚哥分校合作发表于NATURE MATERILS的研究是相对系统性的大规模研究。基于肝癌病人的分期,存活率等大量数据,整合了DNA甲基化数据库的已有信息,开发新的机器学习模型,这项研究在肝癌病人循环DNA的甲基化检测上打下了扎实的基础(11)。
目前莱蒙君泰公司(LAM®,Laboratory for AdvancedMedicine, Inc.)利用该成果已经在国内和多家医院联合开展肿瘤循环DNA甲基化检测(12)。

在美国市场,GRAIL是一家后起之秀。该公司计划2018年在香港融资上市,5月21日宣布公司完成3亿美元的C轮融资,由汇桥资本、高瓴资本与通和毓承共同领投,蓝池资本、招商证券国际、国新科创基金、黄浦江资本(HPR)、工银国际、红杉资本,以及明码生物等参与投资。

从测序巨头Illumina公司分离出来的GRAIL,两年前开始了一项规模浩大的循环肿瘤DNA的测序计划。该项计划招募病人数达万人,计划耗时五年,利用三种最成熟的循环肿瘤DNA检测技术:肿瘤DNA特定位点的变异检测(所用工具即上文提到的MSK-IMPACT系统);肿瘤DNA的全基因组检测;以及肿瘤DNA的甲基化检测。检测包括肺癌,卵巢癌,胰腺癌,肝癌,食管癌等多种肿瘤类型,三种方法并行检测、比较,以期相互印证,分选优劣。
目前的阶段性研究报告可以看出,这样的检测策略,大大提高了检测的灵敏度和特异性(7,9)。五年随访检测后,相信会给业界建立扎实的操作平台,树立良好的参考标准。
4
循环肿瘤DNA检测不仅仅是检测技术
从循环血中提取肿瘤DNA并测序,起初的意义就是要在无创或微创的条件下,能够对肿瘤做出早期诊断,甚至可以帮助医生对肿瘤的治疗进行监控。所以检测终归只是手段,临床应用才是最终目的。
然而,由于循环肿瘤DNA的低含量以及DNA序列信息的极端复杂性,使得提取检测技术本身一度成为大家专注的焦点。而现阶段提取和检测技术已逐渐被市场化规范化,例如Vela诊断公司的游离DNA提取试剂盒Sentosa® SX,近日已正式获得国家市场监督管理总局批准,将来会广泛服务于临床(13)。
那么当检测技术日趋成熟,检测结果日渐可靠的时候,怎么解读检测结果成为能否整合到肿瘤治疗环节的关键所在。

准确的解读检测结果需要多方面的信息沟通,大批量的反复印证,长时间的临床随访观察。有市场研究也指出,准确解读是目前该领域的技术难点(14)。特定的检测手段只能给出有限的参考信息。比如肿瘤DNA特定位点的变异检测,仅仅能覆盖已知机理的肿瘤发病类型。对于更多的与癌症相关的DNA序列变异,需要靠全基因组测序来识别。但如何确认它们和肿瘤发生之间的关系,如何从海量的DNA序列多样性的噪音背景下,把痕量肿瘤DNA变异的信号筛选出来(7),不光是测序技术的问题,更是检测规模和检测过程设计的问题。
检测出的结果是否可靠还体现在检测出的肿瘤DNA变异是否与肿瘤发病有明确的相关性。临床中利用循环肿瘤DNA检测不仅仅局限于早期的诊断筛查,还对肿瘤治疗的监控有指导意义。这样的问题靠大量的回顾性研究不能有效的回答。需要临床医生,病人,检测部门在整个治疗过程中的密切配合,及时反馈,这也是GRAIL公司计划五年随访研究的意义所在。
循环肿瘤DNA检测是个新兴的领域,但是技术上已经相对成熟。目前的着眼点在建立该领域的规则和参考标准,这是一个边研究边建设的过程。众多的测序公司可以提供大量的反复印证的测序结果,同时更需要临床医生提供治疗及疾病评估的反馈信息。所以cell-freeDNA(cfDNA)检测不仅仅是检测而已,它是多方合作的长时间大投入的肿瘤治疗环节的重要部分。
(图片来源于网络)
参考文献:
1.Circulatingcell-free nucleic acids: characteristics and applications. Pös O, Biró O,Szemes T, Nagy B. Eur J Hum Genet. 2018 Apr 23.
2.http://www.transbiomedicine.com/translational-biomedicine/the-cellfree-mitochondrial-dna-a-novel-biomarker-of-cardiovascular-risk.php?aid=9556
3.CirculatingTumor Cells (CTC) and Cell-Free DNA (cfDNA) Workshop 2016: ScientificOpportunities and Logistics for Cancer Clinical Trial Incorporation. Lowes LE,Bratman SV, Dittamore R, Done S, Kelley SO, Mai S, Morin RD, Wyatt AW, AllanAL. Int J Mol Sci. 2016 Sep 8;17(9).
4.Size-BasedEnrichment Technologies for Non-cancerous Tumor-Derived Cells in Blood.Mong J,Tan MH.Trends Biotechnol. 2018 May;36(5):511-522.
5.Cell-freeDNA (cfDNA): Clinical Significance and Utility in Cancer Shaped By EmergingTechnologies. Volik S, Alcaide M, Morin RD, Collins C. Mol Cancer Res. 2016Oct;14(10):898-908.
6.Next-GenerationSequencing of Circulating Tumor DNA for Early Cancer Detection. Aravanis AM,Lee M, Klausner RD. Cell. 2017 Feb 9;168(4):571-574.
7.https://grail.com/science/
8.https://www.mskcc.org/press-releases/msk-impact-first-tumor-profiling-multiplex-panel-authorized-fda-setting-new-pathway-market-future-oncopanels
9.https://www.businesswire.com/news/home/20180417006580/en/GRAIL-Announces-Data-Prototype-Blood-Tests-Early
10.Circulating Tumor DNAAnalysis in Patients With Cancer: American Society of Clinical Oncology andCollege of American Pathologists Joint Review. Merker JD, Oxnard GR, Compton C,Diehn M, Hurley P, Lazar AJ, Lindeman N, Lockwood CM, Rai AJ, Schilsky RL,Tsimberidou AM, Vasalos P, Billman BL, Oliver TK, Bruinooge SS, Hayes DF,Turner NC. Arch Pathol Lab Med. 2018 Mar 5.
11.Circulating tumour DNAmethylation markers for diagnosis and prognosis of hepatocellular carcinoma.XuRH, Wei W, Krawczyk M, Wang W, Luo H, Flagg K, Yi S, Shi W, Quan Q, Li K, ZhengL, Zhang H, Caughey BA, Zhao Q, Hou J, Zhang R, Xu Y, Cai H, Li G, Hou R, ZhongZ, Lin D, Fu X, Zhu J, Duan Y, Yu M, Ying B, Zhang W, Wang J, Zhang E, Zhang C, Li O, Guo R, Carter H, ZhuJK, Hao X, Zhang K. Nat Mater. 2017 Nov;16(11):1155-1161.
12.https://www.lamoncogroup.com/
13.https://www.prnasia.com/story/212711-1.shtml
14.https://mp.weixin.qq.com/s/SGaFZQlRxHU1C-DvjdpVvQ


本期作者:Stephen 王
德州大学休斯顿健康科学中心博士毕业。现于健康科学中心从事遗传性心血管病研究。任美柏医健研究员。
文章版权归【美柏医健】所有,欢迎转发,转载请参照“转载须知”。
精选内容
美柏路演
▼ 点击阅读原文,查看更多好内容
最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。