LAG3+PD1:专家预测2018年最具潜力肿瘤免疫疗法之一


文/张帆,Zoe
编/Ginger, HLR
肿瘤免疫疗法已经连续几年成为 ASCO 的关注点。作为肿瘤免疫疗法的核心成员,PD-(L)1 无疑是近年来最炙手可热的靶点,已经上市的 PD-(L)1 抑制剂药物每年都带动着几十亿美金的销售额,与之相关的临床研究也高达几千例。
在市场驱动下,今年的 ASCO,和肿瘤免疫检查点抑制剂联合用药的临床试验成为了聚光灯下的重头戏。其中免疫抑制受体(如 LAG-3)的研发结果更是值得期待,因为其既有独当一面的潜力,也有与 PD-(L)1 双剑合璧的可能性。资深分析师 Keith Speights 曾预测 2018 年最有潜力的三项肿瘤免疫疗法之一便是 BMS 的 LAG-3 抑制剂 Relatimab 和 PD1 纳武单抗联合疗法。
本文将从 ASCO 展开,重点分析 LAG-3 当前的临床研究成果。
1
LAG-3
LAG-3 (Lymphocyte-activation gene 3),也叫 CD223,Frédéric Triebel 及其团队于 1990 年首先发现,认定其为免疫球蛋白超家族,在激活的 NK 细胞、T 细胞等免疫细胞表面广泛表达,并与 CD4 的蛋白序列有 20% 的相似度。其配体之一是主要组织相容性复合体 MHC(major histocompatibility complex)II类分子,亲和力甚至强于 CD4。除了膜表面的 LAG-3,还有一种经过剪切的可溶性 LAG3(sLAG3)。
虽然机理还存在争议,但膜蛋白 LAG-3被广泛接受为免疫抑制受体,而肿瘤细胞通过自身表达 MHC II 类分子而结合并激活免疫细胞表面的 LAG-3,逃避免疫抑制。膜表面的 LAG-3 具有免疫抑制功能,但可溶性 LAG-3(sLAG3)却是抗原递呈细胞(APC)的激活剂,以此激活树突状细胞、CD8 T 细胞而增进免疫反应。因此,LAG-3 成为一个有趣的潜在免疫靶点。
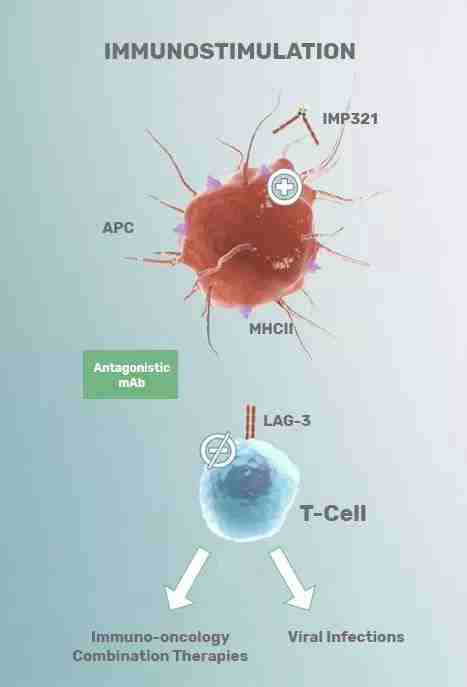
▲ 图片来源:http://www.immutep.com/technology/lag-3-technology.html
Frédéric Triebel 首先研发了可溶性 LAG-3 重组蛋白(IMP321, Eftilagimod alpha, LAG-3Ig),作为抗原递呈细胞(APC)的激活剂,调节 T 细胞免疫应答。于 2001 年创建公司 Immutep S.A.,致力于应用免疫疗法治疗癌症和自身免疫疾病,利用其技术和专业知识为患者带来创新的治疗方案,同时也为股东创造最大价值。2014 年,Immutep S.A. 成功被 Prima Biomed(后改名为Immutep) 以 $28M 收购。
目前 Immutep 主要产品仍是基于 LAG-3 免疫控制机制研发的世界一流的 APC 激活剂-可溶性 LAG-3Ig 融合蛋白 eftilagimod alpha,既可在低剂量持续地诱导免疫应答或癌症疫苗辅助剂,也可在较高剂量改善全身机能。而且其临床实验证明其安全性和耐受性良好,有希望成为其它药物或候选药物的理想联用伙伴。

2
LAG-3 @ ASCO 2018
1. Eftilagimod alpha 联合紫杉醇在转移性乳腺癌一线治疗中初见成效 (摘要号1050,临床试验注册号NCT02614833)
实验方法: 15 例激素受体阳性的转移性乳腺癌患者(67%接受过激素治疗)首先进行二期临床安全性导入期实验,分别在第 1、8、15天接受 80 mg/m2一线药物紫杉醇;分别在第 2、16 天联合 Eftilagimod alpha 皮下注射 6 mg (6例患者)和 30 mg (9例患者),持续 6 个循环;无疾病进展的患者将每一个月接受一次 Eftilagimod alpha 单药,最多 12 次。于第 1、4、6 个循环采取血样,监测药代动力学和免疫学参数。
结果显示:九例患者出现严重副作用,其中1例与紫杉醇副作用相关 (头晕Gr3),1例与Eftilagimod alpha相关(细胞因子释放综合征Gr1);无Gr4,4例Gr3副作用与Eftilagimod alpha相关;而Gr1/2注射部位反应则是跟Eftilagimod alpha最为相关也是最普遍的副作用(93%)。联合用药不仅增加了体循环的单核细胞、树突状细胞和CD8 T细胞数量,还提高其免疫活性和时间。持续六个多月的免疫激活也与辅助T细胞的生物标志物(IFN-g, CXCL10)增多相关。7例部分缓解(47%)。疾病控制率为87%。
结论:皮下注射 30 mg Eftilagimod alpha 为二期临床的推荐用量。Eftilagimod alpha 能稳定持续地激活抗原递呈细胞和 T 细胞。
2. Eftilagimod alpha联合紫杉醇二期临床随机、双盲安慰剂对照试验治疗激素受体阳性的转移性乳腺癌(摘要号TPS1109,临床试验注册号NCT02614833)
第一阶段的安全性导入期试验结束后,现在开始第二阶段招募工作,预计在7个欧洲国家的多个试验中心招募 226 名转移性乳腺癌患者(激素受体为阳性,接受过一线治疗紫杉醇但没有 Her2/neu 靶向治疗),进行 1:1 随机、双盲安慰剂对照试验。
实验方法: 第1、8、15天静脉注射 80mg/m2 紫杉醇,第 2、16 天皮下注射 30 mg Eftilagimod alpha 或安慰剂,持续 6 个循环。病情稳定或有好转者可每四个星期接受一次 Eftilagimod alpha 或安慰剂(最多 12 次)。主要终点为无进展生存(Progress Free Survival);次要终点包括总生存和肿瘤反应、疗效起始及持续时间、病情稳固时间和生活质量。
3. 开放标记的一期临床研究,针对晚期实体瘤,评估IMP321(LAG-3Ig融合蛋白)单药注射于肿瘤内、腹腔内和皮下的可行性和安全性 (摘要号TPS3129,临床试验注册号NCT03252938)
这是一项探索性的临床实验,首次临床评估 IMP321 不同给药途径(肿瘤内、腹腔内和皮下注射)的可行性和安全性,而且也掌握了其抗癌功效的第一手资料。这些验证概念的数据也为 IMP321 直接注射到肿瘤块或腹膜间隙的奠定了临床基础。而且还会评估皮下注射 IMP321 联合标准护理(Standard of Care,SOC)化疗(免疫)疗法的安全性和功效。
实验方法: A组:对可以反复注射并活检的预先治疗的实体瘤患者,每两个星期肿瘤内注射一次 IMP321 单药; B组:预先治疗的实体瘤并伴有腹膜癌病的患者通过直接腹内注射或硅导管导入进行 IMP321 单药治疗。这两个阶段都是经典的三例患者队列研究设计,由同一患者接受剂量递增和巩固队列组成。C组:接受一、二线标准护理(SOC)化疗(免疫)疗法的实体瘤患者同时接受 IMP321 皮下注射。
预计招募各 9 例 A 和 B 组、20 例 C 组的志愿者。首要结点是整体回应率。同时也会收集大量的生物标记物研究。招募已经启动,截止到 2018 年 2 月,已有 3 例 A 组和 1 例 B 组患者,目前尚无剂量限制性毒性。
4. Eftilagimod alpha联合Pembrolizumab(PD-1单抗)临床一期剂量递增治疗不可切除或转移性黑色素瘤 (摘要号e15099,临床试验注册号NCT02676869)
实验方法:一期临床招募黑色素瘤患者,接受三个周期 Pembrolizumab(PD-1单抗),未完全缓解或病情发展者继续静脉注射 2 mg/kg Pembrolizumab 联合 1 mg、 6 mg 或 30 mg Eftilagimod alpha 皮下注射,每两个星期一次,持续 6 个月。采集第 1 和 9 周期的血样分析其药效动力学参数及免疫学指标。
结果显示:从 2016 年 4 月到 2017 年 12 月期间的 18 名招募者中,83% 患有脏腑疾病,6 例严重副反应,不存在 Gr4 或以上的副反应或剂量限制性毒性,没有因为副反应退出治疗的患者。8 例(50%)患者肿瘤减小,其中包括 1 例确认完全缓解(曾接受过 Pembrolizumab 单独治疗,但病情发展)。
结论:每两星期皮下注射一次 30 mg Eftilagimod alpha 联合标准剂量 Pembrolizumab 是安全的,并会在更多的招募者中继续研究。联合用药使肿瘤缩小可能表明 APC 激活剂 Eftilagimod alpha 辅助标准免疫疗法可增进疗效。
Immutep S.A.研发的另一个颇具潜力的药物 LAG-525 (IMP701),是膜蛋白 LAG-3 单抗, 阻断 LAG-3 对免疫系统的抑制作用,促进 T 细胞增殖和激活,从而击溃癌症。2012 年 CoStim 制药公司获得 IMP701 的许可,之后被诺华公司(Novartis)收购,并与 Prima BioMed 联合研发。
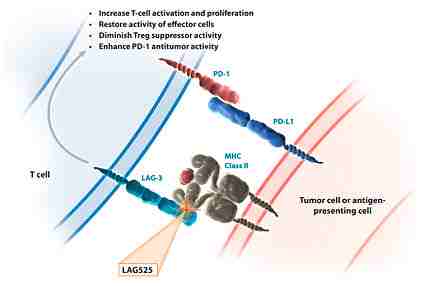
▲ 图片来源:
https://pipeline.novartisoncology.com/ct/pipelineDetails?compound=LAG525&diseaseAcr=RCC
2016 年 1 月 11 日,诺华公司巴赛尔总部宣布,通过与 Surface Oncology 达成的战略联盟和许可协议,诺华公司获得了四项针对肿瘤微环境中的调节性 T 细胞群、抑制性细胞因子和免疫抑制代谢物的临床前计划。这些计划将以单独疗法或者联合诺华公司的其它免疫肿瘤学和靶向治疗管线药物进行研究。目的是增加其免疫肿瘤学管线的多样化和深层次,更有抑制癌症的潜能。这份协议无疑促进了当时刚起步的第一项关于 LAG525 的临床实验(临床试验注册号NCT02460224)和之后更多的临床实验。
接下来,让我们来了解一下今年 ASCO 收录的关于 LAG525 联合spartalizumab (PD-1单抗)的两项临床结果。

5. 联合LAG525、Spartalizumab一二期临床试验治疗恶性肿瘤 (摘要号3012,临床试验注册号NCT02460224)
实验方法:一二期临床试验 LAG525 单药剂量范围为每两个星期一次 (1–15 mg/kg, or 240/400 mg) 或者每四个星期一次 (3–10 mg/kg, or 400 mg),联合剂量分为 15 个剂量梯度,每两个星期一次 0.3 mg/kg LAG525 + 1 mg/kg Spartalizumab 至每四个星期 1000 mg LAG525 + 400 mg Spartalizumab。一期临床实验的目标为确定剂量限制性毒性,安全性,药代动力学,效力和生物标志物。
结果显示:2017 年 7 月 31 日截止的的一期剂量递增试验表明,115/119 (97%) 单独使用 LAG525 的患者和 99/121 (82%)联合用药的患者因病情恶化而终止试验;单独或联合用药各出现 4 位患者出现剂量限制性毒性(LAG525单臂:Gr3 腹腔积液,脂肪酶增加,呕吐;Gr4 急性肾损伤。双臂:Gr3 高血糖,肺炎,脑肿瘤水肿,乏力; Gr 4自身免疫性肝炎),并与剂量无关。普遍相关副作用(≥10%)为,单臂:疲劳(10%);双臂:疲劳(18%),腹泻(15%)和恶心(12%)各8%单臂、双臂出现Gr 3-4副作用。其大致随 LAG525 剂量增加而递增。单双臂均未出现最大耐受剂量。
针对不同实体瘤,121 位采用联合用药的患者中有 11 位部分缓解、1 位完全缓解,其中包括 2/8 例间皮瘤和 2/5 例三阴性乳腺癌患者。三阴性乳腺癌的活检中发现生物标志物呈现从免疫冷淡到免疫激活的转变趋势。
结论:患者对联合用药耐受,并且得以调控其免疫系统。
6. 联合 Spartalizumab (PDR001) 和 LAG525 (LAG-3 单抗)二期临床针对晚期实体瘤和血液恶性肿瘤 (摘要号 TPS2616,临床试验注册号NCT03365791)
二期临床试验为开放式、平行队列,针对小细胞肺癌,胃/食道腺癌,去势抵抗性前列腺腺癌,软组织肉瘤,卵巢腺癌,晚期高分化神经内分泌肿瘤或弥漫性大 B 细胞淋巴瘤。招募者要求 18 岁以上、对其癌症进展有记录、接受过 1-5 线治疗、包括一线及以上免疫检查点联合阻断的单独治疗。每个癌症队列至少 5 例、至多 30 例,预计总共招募 35-210 例。招募者将每三个星期接受 Spartalizumab 联合 LAG525 静脉注射。主要终点为 24 个星期治疗的临床受益率。次要终点包括总生存率、疗效起始及持续时间、肿瘤进展时间和安全性/耐受性。
目前已经有 5 个 PD-(L)1 抑制剂药物上市,无形中增加了其余公司同类药物上市的难度。但 Regeneron 和赛诺菲(Sanofi)却为他们的候选药物 cemiplimab(PD-1 单抗)找到了立足之地-针对尚无特效药的转移性皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)或局部晚期并不适合手术的 CSCC,2018 年 4 月 18 日,美国食品和药物管理局(FDA)接受优先审查cemiplimab的生物制剂许可证申请(BLA)。
鉴于 cemiplimab 针对 CSCC 突破性的疗效,Regeneron 和赛诺菲也尝试了 cemiplimab 在其它肿瘤中的作用,包括非小细胞肺癌(NSCLC)、基底细胞癌等,还有结合其它候选药物的联合治疗,而值得一提的就是 REGN3767(LAG-3 单抗)也是被选中的联合靶点之一,而且也是今年唯一一项被 ASCO 收入的联合 cemiplimab 的临床实验,我们来具体了解一下。

▲ 图片来源:https://www.sec.gov/Archives/edgar/data/872589/000110465918001100/a18-2403_1ex99d1.htm

7. REGN3767(LAG-3单抗)单独或联合REGN2810(PD-1单抗)一期临床针对晚期癌症 (摘要号TPS3127,临床试验注册号NCT03005782)

Regeneron 制药公司研发的 LAG-3 单抗(REGN3767)正在进行一期临床试验,针对晚期肿瘤(包括实体瘤和淋巴癌)的患者,单独使用或者联合Cemiplimab (REGN2810,PD-1 单抗),评估其耐受性、药代动力学和免疫学参数。一期临床招募晚期癌症患者。
实验方法: 剂量递增试验采用改良的 3+3 (4+3)模式,即 REGN3767 单独给药采用 4 个递增剂量,联合疗法采用 3 个剂量。耐受性和药代动力学评估之后,分别选定单独、联合疗法的 REGN3767 剂量,扩大试验规模。预计再招募 15 例淋巴癌患者。未曾接受过或接受过抗 PD-1/PD-L1 疗法的患者都有资格加入,但不能包括接受过抗 LAG-3 疗法的患者。
试验的主要目标是为二期临床确定合适剂量和剂量范围。次要目标是评估所有患者的药代动力学和免疫学参数,以及剂量递增的抗癌功效和剂量扩大的安全性。试验正在美国、英国、爱尔兰和韩国积极招募志愿者。
3
结语
目前 20 项NIH在册针对 LAG-3 的临床试验中有 13 项与 PD-1 抑制剂联用,而本届 ASCO 收录的七项 LAG-3 临床试验中,也有四项联合 PD-1。可见 LAG-3 是一个极受关注的 PD-1 联合靶点。
引用 Prima 公司 CEO Marc Voigt 先生评价诺华 LAG525 进入临床实验阶段的原话, “我们很高兴看到我们的商业合作伙伴成功推进 LAG-3 产品的开发;在过去十二个月中发表的关于其它 LAG-3 定向药物开发计划的临床和非临床数据非常令人鼓舞。” 这无疑增强了我们对 LAG-3 与 PD-1 联用的信心。
然而,并不是所有的联合用药都能起到 1+1>2 的效果。Incyte 公司与 Merck PD-1 抑制剂联用的药物 epacadostat 今年 4 月公布三期临床试验失败,未能提高抑制剂的临床表现,股价大跌。但同时,我们也看到仍有很多的临床试验药物至今潜力强劲,至于要如何更深入地了解免疫检查点抑制剂联合用药的设计原则和市场潜力,请参考我们即将推出的 PD-(L)1 联合疗法专题。
作为历年药物开发的风向标,对各个抗癌药物研究机构和公司而言,ASCO 无疑有着举足轻重的地位。而于今年 5 月 23 日公布的上千份会议摘要,则是提前窥探大会展示成果的最好途径。通过对会议摘要的解读,某些公司的股价已经开始了波动。
与此同时,多家制药巨头斥资十几亿美金在肿瘤免疫检查点联合用药的研发上,倍受瞩目的【Exelixis等】多家公司也会在 ASCO 大会期间公布更多临床试验的数据结果,请大家继续关注美柏的 ASCO 2018 跟踪报告。
参考资料:
1. https://clinicaltrials.gov
2. http://www.immutep.com/
3. Andrews L.P., et al (2017)."LAG3 (CD223) as a cancer immunotherapy target." ImmunologicalReviews, volume 276, page 80–96
4. Nguyen L.T., et al (2015)."Clinical blockade of PD1 and LAG3 — potential mechanisms of action."Nature Reviews Immunology volume15, pages 45–56
5. https://www.statnews.com/2018/05/16/asco-combination-cancer-immunotherapies/
6. https://www.fool.com/investing/2017/12/22/3-promising-cancer-immunotherapies-to-watch-in-201.aspx


本期作者:张帆
毕业于中国药科大学,目前在瑞典卡洛琳斯卡医学院攻读分子生物学博士学位,从事衰老抗癌疗法和MYC小分子抑制剂的研发。现任美柏医健研究员。

本期作者:Zoe
本科毕业于华中科技大学,目前在加州大学圣地亚哥分校攻读纳米工程博士学位,从事肿瘤免疫相关研究。现任美柏医健研究员。
ASCO 靶点解读专题
美柏路演
▼ 点击阅读原文,查看更多好内容
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。