IDO惨败之后,GITR是否能助力Incyte打个翻身仗?


文/Stephen 王
编/Ginger, HLR
GITR 作为肿瘤坏死因子受体超家族的一员,激活 GITR 可以促进消灭肿瘤细胞的T细胞活性,目前虽然已有针对激活 GITR 通路的联合用药临床研究,但市场上尚没有已通过 FDA 审批的 GITR 药物。研发阶段最成熟的是Incyte Biosciences从Agenus授权的GITR激动剂 (INCAGN1876): 共有三项临床试验,其中两项属于GITR激动剂和PD-(L) 1抑制剂联用试验。值得注意的是,这几项试验都是针对晚期实体瘤,而这类肿瘤是治疗的难中之难,一旦攻破,市场不可限量。试验结果将在2018-2019年间公布。
在今年 ASCO 年会上,有五篇关于GITR 单独用药或联合用药的临床试验的最新结果,本文将一一梳理,探讨 GITR 研发的最新动态。
1
GITR
GITR(Glucocorticoid-induced tumor necrosis factor receptor)是肿瘤坏死因子受体超家族中的一员,在调节性 T 细胞(regulatory T cells, Treg)表面的表达量很高。在效应性 T 细胞(effector T cells,Teff)表面也有表达,但当 Teff 被激活后,GITR 的表达量会在短时间内快速升高。GITR 通路在 Treg 和 Teff 内的功能也不尽相同。
激活 Teff 表面的 GITR,可以促进 Teff 细胞的增值和存活。而 Teff 是冲在一线消灭肿瘤细胞的主力军。如果能使 Teff 的活性和数量得到提升,就有可能提高已有的免疫治疗(PD-1, PD-L1抗体治疗)效果。同时,当抗体和 Treg 表面的 GITR 结合后,GITR 通路可以促使 Treg 细胞衰竭。Treg 作为具有抑制 Teff 功能的细胞,诱发其衰竭可以间接的起到激活 Teff 功能的效果。
所以针对 GITR 的抗体会有”一箭双雕”的双重功效 (参见图一),能全面武装免疫系统去攻击肿瘤细胞。

▲ 图一: GITR 作为免疫治疗靶点在 T 细胞中的作用模式。
D.A. Knee et al. / European Journal of Cancer 67 (2016) 1-10
目前进入临床的 GITR 抗体药就是针对激活 GITR 通路,很多也是从联合用药角度出发进行试验的,下面表格总结了近期已经在临床研究中的以 GITR 为靶点的药物。其中 AMG228 由于商业原因已提前终止。OncoMed Pharmaceuticals 公司于去年底新开一期临床试验,测试 OMP-336B11 在晚期或转移瘤病人中的抗癌效应。在此次 ASCO 大会上,默克公司(Merck & Co.)将对 GITR 激活剂 MK-1248 单克隆抗体的一期临床试验结果做初步报告。在此也总结了其余涉及检测研究 GITR 表达量的摘要。
▼ GITR靶点药的临床试验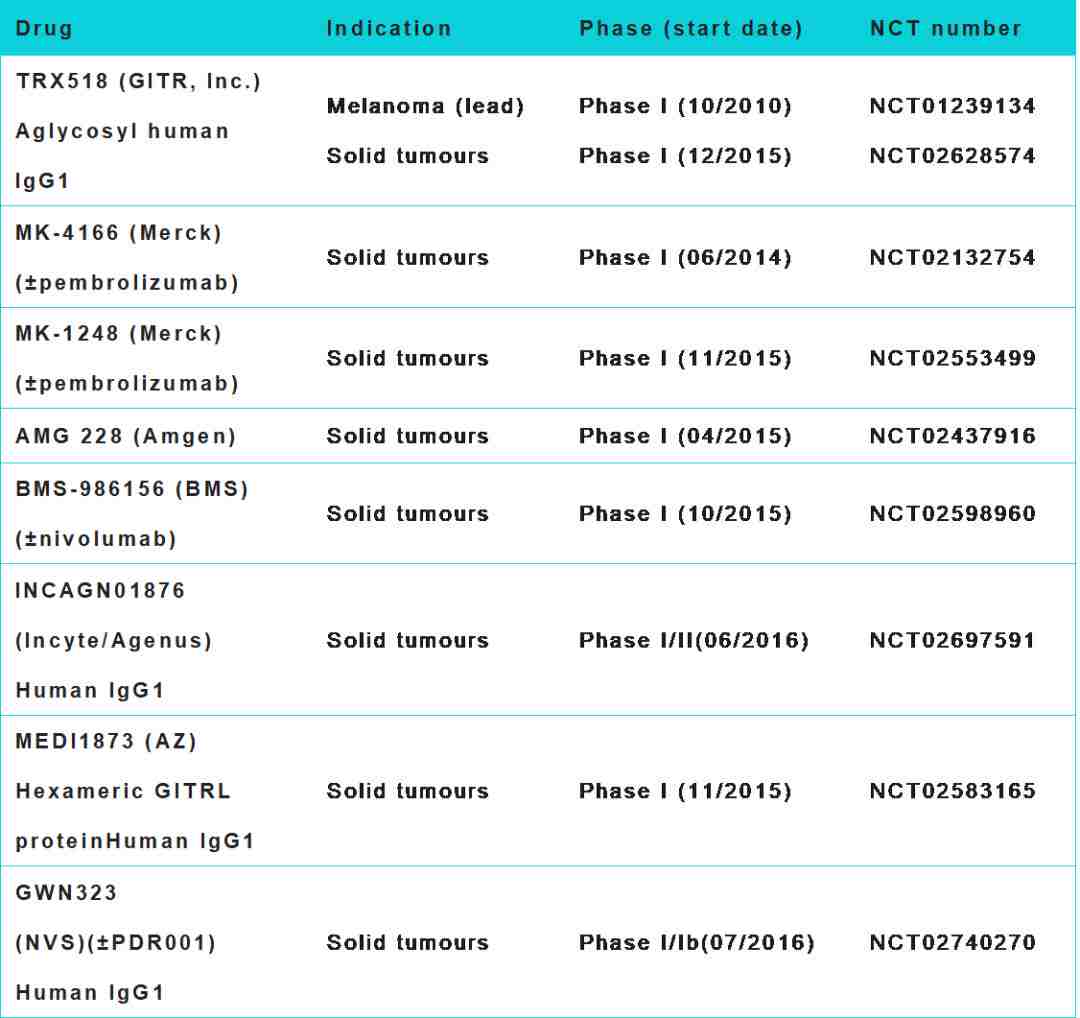

D.A.Knee et al. / European Journal of Cancer 67 (2016) 1-10
2
GITR @ ASCO 2018
1. 一期临床研究(临床实验注册号NCT02553499, 摘要号3029)
MK-1248, GITR 单克隆抗体, 单独用药或联合用药在晚期实体瘤病人中的一期临床试验结果。
实验主要目的是检测 MK-1248 单独用药或联合用药的安全性,耐受性,最大耐受剂量,药效动力学还有药代动力学的一些常规指标。目前共总结 37 个病人的试验结果,其中 20 个病人为 MK-1248 单独用药,17 个病人是联合用药。肿瘤类型包括结肠癌, 黑色素瘤, 肾细胞癌,以及其他 16 种实体瘤。MK-1248,每三周一次静脉给药,单独用药时最大剂量 170 毫克。联合pembrolizumab(200 毫克固定剂量)使用时最大剂量为 60 毫克。
病人耐受良好。36 个病人有超过一项副反应。17 个病人有超过一项和治疗相关的副反应。常见的副反应包括呕吐, 食欲不振,下腹痛,咳嗽,腹泻,恶心,乏力头痛,发热。六个病人在单一用药时有严重副反应,五个病人在联合用药时有严重副反应。没有剂量限制性毒性, 没有治疗相关性的死亡。一例治疗达到完全缓解,两例部分缓解。
结论:MK-1248 在单独用药 170 毫克,联合用药 60 毫克条件下耐受良好,没有剂量限制性毒性,无治疗相关性死亡。在联合 pembrolizumab 治疗时,可观察到治疗反应性。

既然是联合用药,把 GITR 作为治疗的靶点选择之一,首先就要了解 GITR 的表达特点。也正是基于 GITR 的表达在肿瘤的发生发展不同阶段的变化各不相同,确认它的表达情况,从而有针对性的制定治疗方案,成为个体化精准治疗的一种尝试。
比如下面几个摘要,就是利用了包括 GITR 在内的多种生物靶点的表达差异,试图寻找可靠的相关性,为肿瘤治疗甚至预后提供参考。
2. 一期临床研究 (临床实验注册号 NCT03335540, 摘要号 TPS3101)
非盲(open-label)可调性(adaptive)生物标记物一期临床试验为肿瘤免疫联合治疗提供个体化治疗的精确方法。
该研究的主要目的是把肿瘤病人个体的肿瘤微环境和肿瘤免疫治疗药物的使用相结合。
共招募大于 18 岁的 50 个实体瘤病人。ECOG PS(Eastern Cooperative Oncology Group Performance Status)体能评分小于 1 (能够从事正常的日常活动或轻体力活动),并且之前有至少一次肿瘤治疗的病史。病人将接受 PD-1 单抗(nivolumab)治疗,同时结合第二个针对免疫脱靶效应的肿瘤免疫治疗药物的治疗(lirilumab, anti-KIR;relatlimab, anti-LAG-3;cabiralizmab, anti-CSF-1R;ipilimumab, anti-CTLA-4; BMS-986205, IDO-1 inhibitor; BMS-986156, anti-GITR),新的治疗方案将根据给药前的肿瘤生物标记物的分析来决定。
一期临床的主要实验指标是找到能够提供足够生物标志物结果的肿瘤病人的比例。其它的指标包括安全性,前期临床活性和肿瘤生物标记物的分析。
3. 检测研究 (摘要号 e15131)
免疫治疗的早期阶段,通过检测外周血细胞中阳性和阴性生物标记物以预测晚期癌症病人的治疗反应。
该研究试图建立外周血单核细胞免疫生物标记物和临床预后之间的关系。共25个病人,用 nivolumab 或者 pembrolizumab 抗体治疗, 同时结合或者不结合化疗。检测了 CD4 阳性,CD8 阳性,和 NK 细胞表面九个检验点分子在治疗前后的表达变化,包括:PD-1, CTLA-4, TIM-3, LAG-3, BTLA, CD160, Ki-67, OX40和GITR。
结论:结果发现疗效良好组在首轮免疫治疗后,CD4阳性细胞和NK细胞表面的PD-1表达量升高。而第二轮免疫治疗后,CTLA-4, GITR和OX40表达量下降。因此在肿瘤治疗早期通过检测病人的外周血单核细胞表面的生物标记物,对标记物表达情况的整合,可以预测肿瘤免疫治疗的效果。
4. 检测研究 (摘要号 7016)
AML病人中伴随T细胞耗竭出现的调节性T细胞的浸润和免疫检验点的表达
通过流式细胞技术测试 107 个 AML 病人的骨髓提取物,评估抑制性受体(PD-1, CTLA-4, LAG3, TIM3)和激活性受体(GITR, OX40, 41BB, ICOS)在T细胞亚型中的表达情况以及这些受体的配体(41BBL, B7-1, B7-2, ICOSL, PDL1, PDL2, OX40L)在AML母细胞当中的表达情况。
同时研究人员把这些标记物的表达水平和病人的年龄、 核型以及 28 个骨髓细胞相关基因的序列关联起来。和健康人群相比,骨髓提取物 CD45 阳性细胞在新发和复发的 AML 病人中,会伴随有以下各生物标记物的显著升高:CD3 阳性 T 细胞,调节性 T 细胞,PD1+CD8+T 细胞,OX40+CD8+T 细胞,PD1+CD4+ 效应性 T 细胞以及 OX40+CD4+ 效应性 T 细胞。和健康人群相比,新发和复发的 AML 病人中,耗竭性 PD1+TIM3+CD8+ T 细胞,PD1+TIM3+CD4+ 效应性 T 细胞,PD1+LAG3+CD8+ T 细胞和 PD1+LAG3+CD4+ 效应性 T 细胞的量均升高,且呈双相分布。
结论: 在 AML 骨髓提取物中调节性 T 细胞浸润和 T 细胞耗竭的频率增多,意味着免疫反应的耗竭恶化。 研究结果认为那些参与免疫抑制的通路在 AML 的存活率上发挥重要作用。 因此病人有可能会受益于这些通路上免疫检验点抗体的治疗。
PD-1通路是免疫治疗的主要靶点。然而并不是所有肿瘤都有 PD-1 通路的功能激活。即便是在PD-1通路激活的肿瘤中,依然有很多情况,使用PD-1通路的免疫治疗药效果不理想。
下面两个摘要,针对这个问题,做了临床上的肿瘤分型,根据其它免疫靶点(包括GITR)的表达情况,以期找到合适的联合治疗的新靶点。
5. 摘要号e15058, e15054
AML病人中伴随T细胞耗竭出现的调节性T细胞的浸润和免疫检验点的表达
该研究将患有 32 种不同肿瘤的 477 个病人的组织切片染色。除了 PD-1, PD-L1, PD-L2 三个免疫靶点外,还包括了很多其它的免疫治疗靶点。通过靶点的表达结果分析,把肿瘤分为两个大类:PD-1 通路激活肿瘤和非 PD-1 通路激活肿瘤。在 477 个肿瘤病人当中, 有 58% 的病人可归于非 PD-1 通路激活肿瘤。在这些肿瘤当中最常见的表达量升高的其它免疫治疗靶点依次是CSF1R(14%), GITR(11%), IDO1(10%)和TNF(10%)。在剩余的 PD-1 通路激活肿瘤病人中,最常见的表达量升高的免疫治疗靶依次是 TGFB1(50%), CSF1R(48%), TNF(33%)和ICOS(32%)等。
结论:在 PD-1 和非 PD-1 通路激活肿瘤中都有大量的免疫治疗靶点的升高。为下一步多靶点的联合免疫治疗提供理论支持。同时, 研究提示非 PD-1 通路激活肿瘤中最常见的免疫抑制机制是髓细胞抑制(CSF1R)和免疫逃避(IDO1)。
3
结语
Incyte 在 IDO 抑制剂和派姆单抗三期临床试验告败后股票一蹶不振。在肿瘤免疫领域,除 IDO 和 GITR 外,Incyte 还有靶向 PD-1,ARG,OX40 的临床管线,这些种子选手们谁能给 Incyte 扳回一局还都是未知数,但鉴于 GITR 通路对T细胞活性的调节功能,作为联合用药的免疫靶点之一,GITR 单抗的临床试验值得持续关注。

想要了解更多治疗靶点单独用药或联合用药在临床研究中的新进展,请继续关注我们即将推出的PD-(L)1联合疗法专题。
参考文献:
- PD-(L)1联合疗法专题
- Rationale for anti-GITR cancer immunotherapy. Knee DA, Hewes B, Brogdon JL. Eur J Cancer. 2016 Nov;67:1-10.
- Modulation of GITR for cancer immunotherapy. Schaer DA, Murphy JT, Wolchok JD. Curr Opin Immunol. 2012 Apr;24(2):217-24.


本期作者:Stephen 王
德州大学休斯顿健康科学中心博士毕业。现于健康科学中心从事遗传性心血管病研究。任美柏医健研究员。
ASCO 靶点解读专题
美柏路演
▼ 点击阅读原文,查看更多好内容
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。