CAR-T 细胞疗法应用于实体瘤治疗的挑战和解决方案
CAR-T 细胞疗法的发展历史
早在二十世纪初,科学家就发现T 细胞可以高效地杀伤肿瘤细胞,并尝试了使用各种方法增强人体内T细胞到达肿瘤部位、识别肿瘤细胞的杀伤能力。
随后,发展于1950年代的骨髓移植技术奠定了肿瘤细胞疗法的基础。这是现代医学第一次通过输入外源细胞来控制血液肿瘤的尝试。
1987年,以色列免疫学家Zelig Eshhar, 发明了世界上首个嵌合抗原受体(CAR),并通过实验证明,经过基因改造后表达CAR 的 T细胞由于具有来源于抗体的抗原识别片段,当接触到肿瘤细胞后,可以迅速被激活,大量增殖并发挥肿瘤细胞杀伤功能。
更神奇的是,研究发现这种T细胞可以在人体内存在数年,随时准备对表达抗原的肿瘤细胞发起进攻。
从1980年代开始,科学家开始通过各种临床前和临床实验探索CAR-T细胞疗法用于肿瘤治疗的可能性,其中的先驱包括美国国家癌症研究所的Steven Rosenberg 博士,宾夕法尼亚大学的Carl June 博士,以及斯隆·凯特琳癌症中心的Michel Sadelain博士等。

图2. 美国国家癌症研究所的Steven Rosenberg 博士,宾夕法尼亚大学的Carl June 博士,以及斯隆·凯特琳癌症中心的Michel Sadelain博士
图片来源于网络
CAR-T细胞疗法首次在Steven Rosenberg博士主导的晚期滤泡淋巴瘤病人的治疗研究中取得了成功。
随后,2011年,宾夕法尼亚大学的David Porter 博士报道,两位经CAR-T细胞疗法治疗的慢性淋巴细胞白血病(CLL)病人实现完全缓解(数据来源:The New England Journal of Medicine,DOI: 10.1056/NEJMoa1103849)。
近乎同时,宾夕法尼亚大学、斯隆·凯特琳癌症中心、美国国家癌症研究所报道CAR-T疗法在各自的儿童和成人急性B淋巴细胞白血病(ALL)治疗临床试验中取得惊人的效果。在费城儿童医院的Stephan Grupp 博士主导的临床试验中,90%的ALL病人输入CAR-T细胞后实现完全缓解 (数据来源The New England Journal of Medicine, DOI: 10.1056/NEJMoa1407222)。
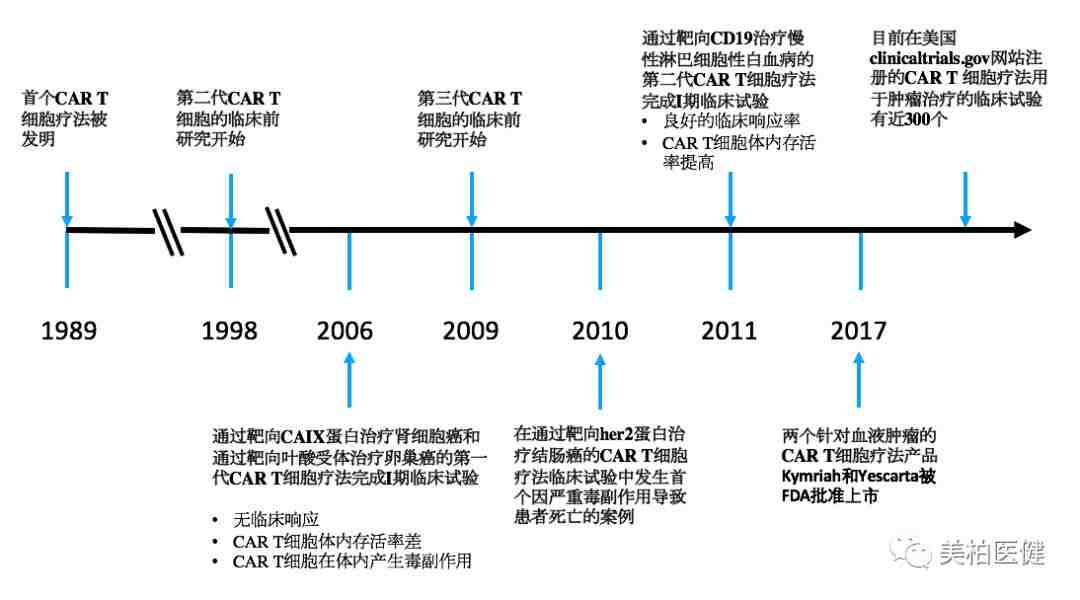
CAR-T细胞疗法的发展历史
2017年对CAR-T细胞疗法而言,无疑是具有里程碑意义的一年。
8月,诺华的tisagenlecleucel (Kymriah) 经FDA全票通过被批准用于儿童及青年急性淋巴性白血病治疗。
同年10月,FDA批准第二个CAR-T细胞疗法,Gilead旗下公司Kite制药产品axicabtagene ciloleucel (Yescarta),用于弥漫性大B细胞淋巴瘤治疗。随着这两个CAR-T产品的成功获批,肿瘤治疗正式进入新纪元。

宾夕法尼亚大学医学院庆祝Kymriah获得FDA批准的场景
图片来源于网络
CAR-T 细胞的抗肿瘤机理
在结构上,CAR由胞外的单链抗体(scFv)区域、跨膜区域、胞内的T细胞活化信号域(通常是CD3ζ链)和协同刺激信号域(CD28, 41BB, OX40等)组成。
不同于普通T细胞通过T细胞受体(TCR)识别抗原,CAR-T细胞通过胞外的scFv识别肿瘤细胞表面的肿瘤相关抗原(TAA),而不受主要组织相容性复合体的限制。
第一代CAR仅有来自CD3ζ链的活化信号,当scFv 识别到TAA后将信号转入胞内,由CD3ζ信号引发T 细胞的激活。在第二代、第三代CAR中加入的协同刺激信号进一步增强了T的增殖能力、肿瘤细胞杀伤能力和分泌细胞因子的能力(IL-2, TNFα, IFN-γ等)。
CAR-T细胞杀伤肿瘤细胞的机理主要包括:(1)分泌穿控素和颗粒酶B; (2) 通过 Fas/Fas配体或TNF/TNF受体激活死亡受体信号。
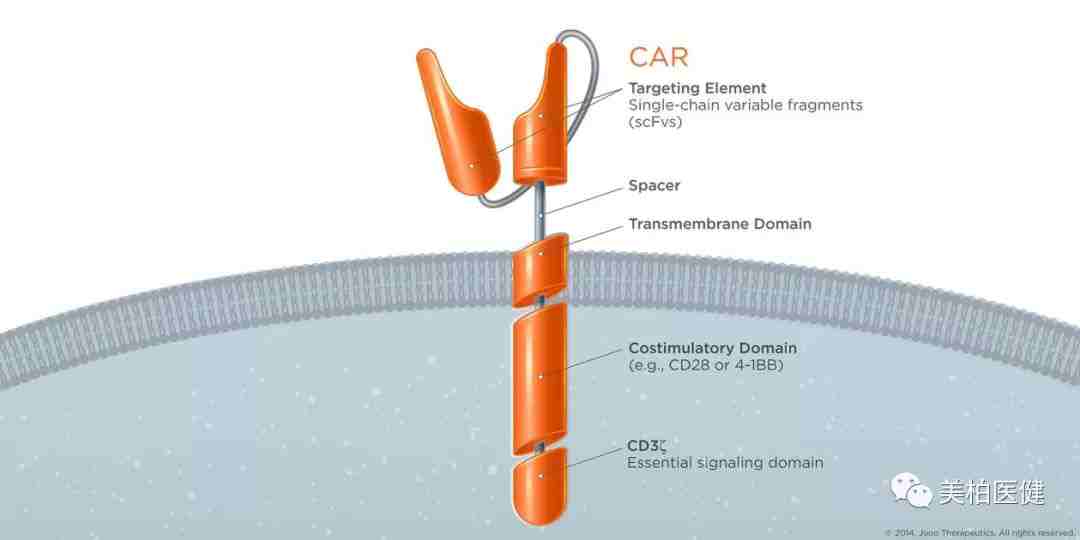
第二代CAR结构
图片来源:Juno Therapeutics
CAR-T 细胞疗法临床研究现状
近年来,CAR-T 细胞疗法相关的研究飞速发展,在针对血液肿瘤的成功案例鼓舞下,利用CAR-T治疗实体瘤也在巨大的挑战中稳步前行。
随着生物医药产业对这一领域的重视程度越来越高,基于CAR-T 细胞疗法的临床试验数量持续增加。目前在美国clinicaltrials.gov网站注册的CAR-T 细胞疗法用于肿瘤治疗的临床试验有近300个。
A)靶向血液肿瘤抗原的 CAR-T 细胞疗法
目前为止,大多数临床试验还是关于靶向B细胞抗原分子CD19的CAR-T 细胞疗法的研究,但这种状况正在改变。
比如,部分ALL病人不能对CD19 CAR-T 细胞产生响应,或者在完全响应后的一年内由于ALL细胞的CD19抗原丢失而病情复发。
针对这个问题,研究人员把目光转向了另一个在ALL细胞表面过表达的抗原分子CD22。在首个靶向CD22的 CAR-T细胞疗法临床试验中,73%的病人实现完全缓解,其中包括接受CD19 CAR-T 细胞疗法后复发的病人 (数据来源nature medicine doi: 10.1038/nm.4441, 临床试验代码:NCT02315612)。
但实际上,CD22 CAR-T细胞疗法治疗后疾病复发的现象也并不罕见。为了提高CAR-T 细胞疗法缓解ALL的持久性,避免由于抗原丢失而导致的疾病复发,多个团队采用了同时靶向两个抗原的研究策略。
例如,同时靶向CD19和CD22的CAR-T细胞疗法正在进行早期临床试验,同时靶向CD19和另一个常见的ALL过表达抗原CD123的CAR-T细胞疗法在动物模型中被证明可以有效防止抗原丢失。
CD123同时也是难治性血液肿瘤的重要靶点。日前在美国希望之城国家医疗中心进行的CD123 CAR-T 细胞疗法I期临床试验证明了该种疗法在急性骨髓性白血病(AML)和胚胎浆细胞样树突状细胞肿瘤(BPDCN)治疗中的应用潜力。
在骨髓瘤的治疗研究中,B细胞成熟抗原(BCMA)因其在B细胞上表达的特异性逐渐成为一个明星靶点。
今年8月,Kite制药针对多发性骨髓瘤的BCMA CAR-T细胞疗法临床试验得到 FDA批准。12月,ASCO的一匹黑马“南京传奇”递交了中国首个CAR-T细胞药物临床申请,其治疗策略也是利用BCMA作为靶点。最近,Celgene和BlueBird生物公司联合开发的针对复发或难治多发性骨髓瘤的BCMA CAR-T细胞疗法更是获得FDA突破性疗法认定。
目前,多个基于BCMA CAR-T细胞疗法的临床试验正在进行中,预示着BCMA靶点可能成成为CAR-T的下一个金矿。
B) 针对实体瘤抗原的CAR-T 细胞疗法
CAR-T 细胞疗法在血液肿瘤治疗中取得的空前成功激励着人们把这一技术扩展应用到实体瘤上,越来越多的针对实体瘤抗原的CAR-T 细胞疗法临床试验相继开展。
例如,通过靶向癌胚抗原(CEA)治疗结直肠腺癌,通过靶向成纤维细胞活化蛋白(FAP)治疗恶性胸膜间皮瘤,通过靶向神经节苷脂 GD2治疗神经母细胞瘤,通过靶向间皮素治疗胰腺癌,通过靶向表皮生长因子受体(EGFR)治疗非小细胞肺癌等。
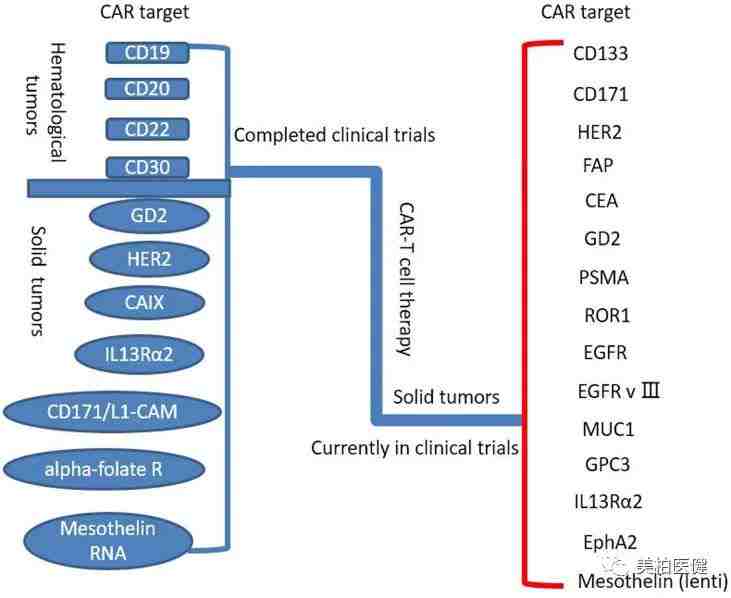
已完成和正在进行的CAR-T 细胞疗法临床试验
图片来源:Oncotarget
然而,临床试验的结果却往往不尽如人意,CAR-T 细胞疗法用于实体瘤的治疗效果远不如血液肿瘤,且常伴随毒性。
这种差异由多种因素造成:
(1)血液肿瘤细胞是分散的,而实体瘤在早期通常会在某个器官形成较为坚实的团状物,不但给免疫细胞的进入造成了重重障碍,其间还有多种具有免疫抑制作用的细胞和分子;
(2)血液肿瘤细胞携带肿瘤相关抗原的水平相近,而实体瘤细胞的抗原表达水平在不同肿瘤类型之间,以及同种类型肿瘤的不同阶段之间均有差异;
(3)血液肿瘤的抗原具有特异性,在其他正常组织没有表达,而针对实体瘤的抗原一般在其他部位,如心脏、肺、肝脏等有少量表达,这就伴随了治疗的脱靶效应。
CAR-T 细胞疗法应用于实体瘤治疗的挑战和解决方案
A)CAR-T细胞转运和肿瘤浸润
相较于血液肿瘤,实体瘤可以分泌趋化因子如CXCL12和CXCL5,阻止CAR-T细胞抵达肿瘤。同时,实体瘤细胞分泌极少帮助CAR-T细胞转运的CXCR3 和CCR5配体。这两个因素使 CAR-T细胞到达实体瘤部位的路途困难重重。
为了和肿瘤细胞分泌的趋化因子更好地配对,有研究通过基因改造在CAR-T细胞上引入相关的趋化因子受体,如CCR2b,借助肿瘤细胞大量分泌的CCL2帮助转运。
也有研究改造能够感染和溶解肿瘤细胞溶瘤病毒,使其能够分泌趋化因子CCL5,和CAR-T细胞表达的受体CCR5配对,引导CAR-T细胞到达肿瘤。
实体瘤的另一个特点是在基质细胞中含有大量的肿瘤相关成纤维细胞。这些细胞通过分泌胶原蛋白,形成致密的肿瘤组织,导致肿瘤内异常升高的间质压,成为阻挡CAR-T细胞浸润的物理屏障。
有研究表明,通过使用靶向成纤维细胞活化蛋白(FAP)的CAR-T细胞,可以显著杀伤肿瘤相关成纤维细胞,有效抑制肿瘤生长。另一个方法是使CAR-T细胞同时表达乙酰肝素酶,通过乙酰肝素酶降解肿瘤的纤维化细胞外基质,克服物理屏障。
B)具有免疫抑制性的肿瘤微环境
首先,实体瘤内部普遍存在的低pH、低氧、营养贫乏的状态非常不利于CAR-T细胞的存活和活化。
许多研究在实体瘤病人的组织提取物中还发现部分可溶性分子具有也免疫抑制性,例如肿瘤细胞和巨噬细胞分泌的前列腺素E2 (PGE2),肿瘤细胞和髓源抑制性细胞(MDSC)分泌的吲哚胺2,3-二氧化酶(IDO),以及多种细胞在低氧环境下产生的ATP代谢产物腺苷。
目前的解决思路主要是将CAR-T细胞和针对这些分子或其受体的抑制剂联用,从而减轻来自于他们的抑制性作用。
另一部分抑制性信号来自于实体瘤部位的细胞因子,其中以转化生长因子β(TGFβ)的抑制作用最为明显。
TGFβ可以促进调节性T细胞的成熟,并且抑制CAR-T的细胞杀伤能力。通过使用可溶性TGFβ受体或抗体进行系统给药的方法已经在动物模型中被证明可以显著提高CAR-T细胞疗法效果。
在前文中已有提及,在实体瘤部位有多种免疫细胞在对CAR-T细胞的抑制作用中扮演着重要的角色,如调节性T细胞、髓源抑制性细胞、M2型肿瘤相关巨噬细胞、N2型肿瘤相关中性粒细胞。
髓源抑制性细胞、M2型肿瘤相关巨噬细胞、N2型肿瘤相关中性粒细胞可以生成TGFβ、PGE2、活性氧,直接抑制CAR-T细胞功能,其中髓源抑制性细胞还有很高的PD-L1表达水平,可以和CAR-T细胞表面PD1分子结合,引发抑制性信号。调节性T细胞抑制CAR-T细胞功能的机理则是通过分泌TGFβ和细胞因子IL-10。
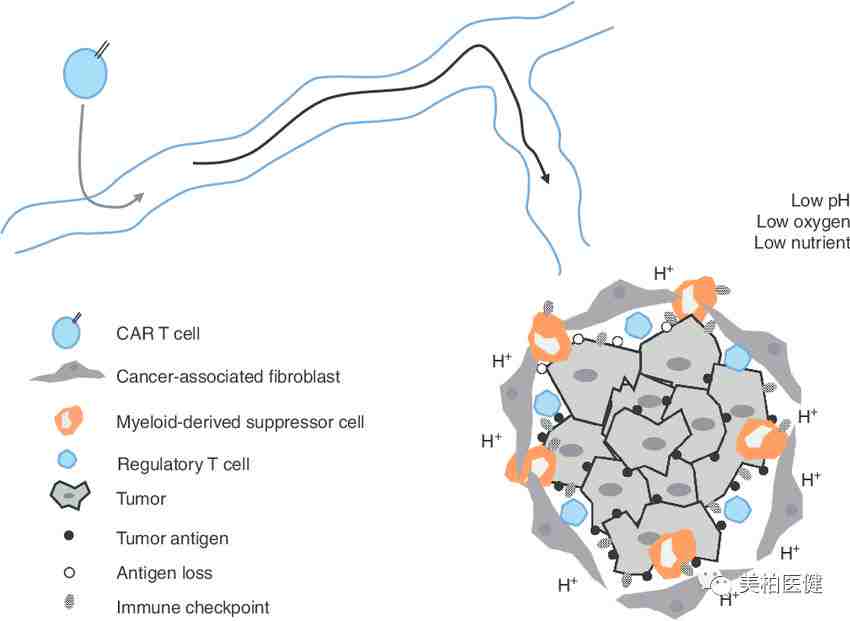
具有免疫抑制性的免疫微环境
图片来源: Molecular Therapeutics
C)CAR-T细胞的自我调节机制
在免疫耐受中起重要作用的T细胞表面分子CTLA4和PD1 等在CAR-T细胞被抗原激活后,通过和相关配体结合,抑制CAR-T细胞的增殖和细胞因子分泌功能。
特别是在肿瘤浸润CAR-T细胞上,这些抑制性分子表达进一步上调,其介导的下游信号大大限制了CAR-T细胞在实体瘤部位的抗肿瘤免疫效应。
多个研究已经表明,使用这些受体的抑制剂可以增强CAR-T细胞疗法的治疗效果。
例如,HER2 CAR-T细胞和mesothelin CAR-T细胞与PD1抑制剂的联用均在动物实验中表现出显著增强的抗肿瘤效果。也有研究使CAR-T细胞表达PD1开关受体,通过将PD1的胞外部分与激活性受体的胞内部分融合,逆转抑制信号为激活信号。
除了表面抑制性受体上调外,CAR-T细胞受抗原刺激后也会激活一系列的负反馈信号通路,主要包括一些酶,如二酰甘油激酶(DGK)、磷酸酶、泛素连接酶等,和一些转录因子,如DNA结合蛋白Ikaros等。目前有很多临床前和临床研究尝试通过抑制这些分子增强CAR-T细胞的功能。
D)CAR-T细胞的脱靶效应
CAR-T细胞对肿瘤细胞杀伤作用主要依赖于对肿瘤相关抗原(TAA)的识别。这些抗原常常过表达在肿瘤细胞表面,但在其他正常组织细胞上也有一定程度的表达。CAR-T细胞攻击表达TAA的正常细胞的现象被称为脱靶效应。
这种脱靶效应在实体瘤治疗中非常常见,并导致了严重的毒副作用。因此,通过不同策略提高CAR-T细胞疗法的特异性和安全性对之后在实体瘤治疗中成功应用至关重要。
有研究团队将CAR-T细胞胞内的活化信号和协同刺激信号进行拆分,分别连接胞外识别两个不同抗原的单链抗体。仅当识别到同时表达两种抗原的细胞(通常是肿瘤细胞)时,CAR-T细胞才能得到充分的激活。
或者,在常规CAR-T细胞的基础上,引入一个能识别正常细胞表面分子并引发抑制性信号的CAR,由此避免CAR-T细胞在正常组织部位被激活 。
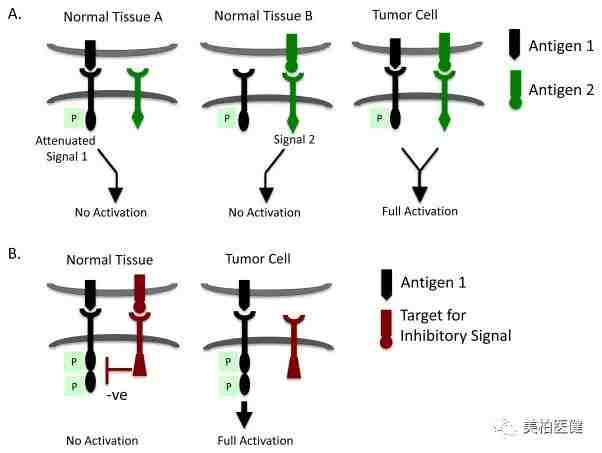
通过拆分受体提高CAR-T细胞对肿瘤细胞选择性识别的策略
图片来源:Trends in Immunology
另一个方法是调节CAR对TAA的亲和性,使得CAR-T细胞能够区分TAA高表达的肿瘤细胞和TAA低表达的正常细胞,仅能在肿瘤部位被激活。
药物设计中前体药物的策略也为这个问题的解决提供了新的思路,有团队在CAR的scFv上游引入能掩蔽scFv抗原结合区域的多肽序列,并通过蛋白酶敏感的序列和scFv连接。由于实体瘤部位常有丰富的蛋白酶为肿瘤细胞的存活和转移提供方便,CAR-T细胞到达实体瘤部位后其蛋白酶敏感序列可以被切断,掩蔽多肽序列失去连接脱离scFv,CAR-T细胞因此恢复正常的抗原识别能力被激活。
CAR-T 细胞疗法应用于实体瘤治疗的未来展望
CAR-T 细胞疗法自诞生以来就被寄予厚望,尽管目前在实体瘤的治疗中还未取得令人满意的效果,随着我们对肿瘤环境以及影响CAR-T 细胞抗肿瘤作用影响因素的研究越来越透彻,这一领域一定会得到长足发展。
前文已经对克服实体瘤治疗障碍的各种策略进行了小结,联合治疗是CAR-T 细胞疗法未来发展的必然选择,目前已有许多临床试验在如火如荼进行,旨在针对不同的适应症筛选出最佳的药物联用方案。同时,随着诱导性多功能干细胞技术被引入CAR-T 细胞的制备,敲除TCR的细胞毒性CAR-T细胞的大规模生产也成为可能。
一路荆棘与鲜花相伴,希望CAR-T 细胞疗法这辆小车可以继续驶向远方。
参考资料:
[1] Jackson Hollie J., Sarwish Rafiq, and Renier J. Brentjens. "Driving CAR-T-cells forward." Nature reviews Clinical oncology 13.6 (2016): 370-383.
[2] Newick, Kheng, Edmund Moon, and Steven M. Albelda. "Chimeric antigen receptor T-cell therapy for solid tumors." Molecular Therapy-Oncolytics 3 (2016): 16006.
[3] Xia, An-Liang, et al. "Chimeric-antigen receptor T (CAR-T) cell therapy for solid tumors: challenges and opportunities." Oncotarget 8.52 (2017): 90521.
[4] Fesnak, Andrew D., Carl H. June, and Bruce L. Levine. "Engineered T cells: the promise and challenges of cancer immunotherapy." Nature Reviews Cancer 16.9 (2016): 566-581.
[5] Yu, Shengnan, et al. "Chimeric antigen receptor T cells: a novel therapy for solid tumors." Journal of hematology & oncology 10.1 (2017): 78.
[6] Neelapu, Sattva S., et al. "Chimeric antigen receptor T-cell therapy-assessment and management of toxicities." Nature Reviews Clinical Oncology (2017): nrclinonc-2017.
[7] Yeku, Oladapo O., et al. "Armored CAR-T cells enhance antitumor efficacy and overcome the tumor microenvironment." Scientific reports 7 (2017): 10541.
[8] Ping, Yu, Chaojun Liu, and Yi Zhang. "T-cell receptor-engineered T cells for cancer treatment: current status and future directions." Protein & cell (2017): 1-13.
[9] Srivastava, Shivani, and Stanley R. Riddell. "Engineering CAR-T cells: Design concepts." Trends in immunology 36.8 (2015): 494-502.
[10] https://www.cancer.gov/about-cancer/treatment/research/car-t-cells
[11] https://www.the-scientist.com/?articles.view/articleNo/42462/title/The-CAR-T-Cell-Race/
[12] https://immuno-oncologynews.com/2017/12/12/city-hope-car-t-cell-therapy-study-results-blood-cancer/
[13] https://endpts.com/fda-ema-put-a-star-car-t-from-bluebird-and-celgene-on-the-vip-list/


本期作者:Sharon Chen
本科毕业于北京大学,现南加州大学药学博士在读,主要从事CAR T细胞疗法用于实体瘤治疗的研究。目前担任美柏研究员。
文章版权归【美柏医健】所有,欢迎转发,转载请参照“转载须知”。
投稿或应聘,请将简历发送到
精选内容
美柏路演

▼ 点击阅读原文,查看更多好内容
阅读原文 最新评论
推荐文章
作者最新文章
你可能感兴趣的文章
Copyright Disclaimer: The copyright of contents (including texts, images, videos and audios) posted above belong to the User who shared or the third-party website which the User shared from. If you found your copyright have been infringed, please send a DMCA takedown notice to [email protected]. For more detail of the source, please click on the button "Read Original Post" below. For other communications, please send to [email protected].
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。
版权声明:以上内容为用户推荐收藏至CareerEngine平台,其内容(含文字、图片、视频、音频等)及知识版权均属用户或用户转发自的第三方网站,如涉嫌侵权,请通知[email protected]进行信息删除。如需查看信息来源,请点击“查看原文”。如需洽谈其它事宜,请联系[email protected]。